问题
计算题
1.15 g金属钠跟水反应后,得到100 mL溶液,试计算:
(1)生成的气体在标准状况下是多少毫升?
(2)反应后所得溶液的物质的量浓度是多少?
答案
(1)560 mL (2)0.5 mol·L-1
金属钠跟水反应生成NaOH和H2,要求生成H2的体积和NaOH溶液的物质的量浓度,只要写出化学方程式,找到有关物质的量的关系即可求解。
解:(1)2Na+2H2O====2NaOH+H2↑
2 2 1
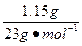 n(NaOH)
n(NaOH) 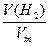
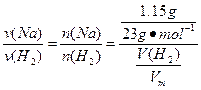
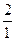 =
=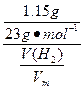
V(H2)=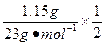 ×Vm=
×Vm=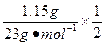 ×22.4 L·mol-1="0.56" L="560" mL
×22.4 L·mol-1="0.56" L="560" mL
(2)n(NaOH)=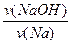 ×n(Na)=
×n(Na)=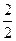 ×
×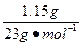 ="0.05" mol
="0.05" mol
c(NaOH)=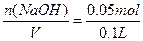 ="0.5" mol·L-1
="0.5" mol·L-1
本题还可用以下格式作解。
解:2Na+2H2O====2NaOH+H2↑
(1)n(Na)=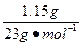 ="0.05" mol
="0.05" mol
n(H2)=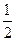 n(Na)="0.025" mol
n(Na)="0.025" mol
V(H2)="0.025" mol×22 400 mL·mol-1="560" mL
(2)n(NaOH)="n(Na)=0.05" mol
c(NaOH)=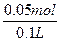 ="0.5" mol·L-1
="0.5" mol·L-1
