实验室制氧气的反应依据为:

(1)发现问题:取7.9g KMnO4晶体加热到220℃,理论上放出氧气______g,换算成标准状况(0℃、101kPa)的体积为560mL,而实际测得氧气的体积为标准状况616mL,多得到的氧气是哪种物质产生的?
(2)提出假设:K2MnO4在220℃可以分解产生氧气.
(3)实验探究:
①另取少量MnO2在酒精灯火焰上加热到220℃,用带火星的木条检验,现象是木条______.
②如图所示,用酒精灯火焰集中加热KMnO4制氧气后的残渣,其结果是______.
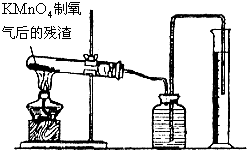
③将实验②得到的最后残渣加入适量水溶解,过滤后得到的固体是______.
(4)获得结论:提出的假设______(填成立或不成立).
(1)设生成氧气的质量为x
2KMnO4
K2MnO4+MnO2+O2↑ △ .
316 32
7.9g x
=316 7.9g 32 x
解得x=0.8g;
(3)①二氧化锰在过氧化氢溶液制取氧气时,只是作为催化剂,没有产生氧气,故另取少量MnO2在酒精灯火焰上加热到220℃,用带火星的木条检验,现象是木条不复燃;
②因为产物中二氧化锰加热不能产生氧气,则猜想锰酸钾可以产生氧气,因此相应的现象是:又产生一定体积的氧气;
③因为二氧化锰不溶于水所以可以利用过滤的方法得到二氧化锰;
(4)根据实验的结果得出的结论是锰酸钾可以受热继续分解产生氧气,故提出的假设成立.
故答案为:(1)0.8;
(3)①不复燃;②又产生一定体积的氧气;③MnO2;
(4)成立.
