某一资料中记载着可以用电解KI水溶液的方法进行KIO3的工业化生产的信息,总的电解反应方程式为:KI+3H2O KIO3+3H2↑。
KIO3+3H2↑。
(1)据此推测:
①阳极反应式是 ;
②阴极反应式是 。
(2)一位学生想演示这一方法,则他应该准备的物品和试剂是。
(1)①I--6e-+3H2O
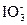 +6H+
+6H+
②6H2O+6e- 3H2↑+6OH-
3H2↑+6OH-
(2)KI溶液、直流电源、导线、两根石墨棒(只要阳极属于惰性电极就可以)、烧杯
(1)①阳极是失电子、发生氧化反应的场所,因而氧化反应I-
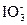 在阳极上进行。这一变化过程中失去6个电子,并且需要3个水分子提供3个氧原子,进而产物中会有6个H+生成。综合以上分析可写出阳极上的电极反应式为:I--6e-+3H2O
在阳极上进行。这一变化过程中失去6个电子,并且需要3个水分子提供3个氧原子,进而产物中会有6个H+生成。综合以上分析可写出阳极上的电极反应式为:I--6e-+3H2O
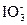 +6H+。②阴极是得电子、发生还原反应的一极,因而还原反应H2O
+6H+。②阴极是得电子、发生还原反应的一极,因而还原反应H2O H2↑在阴极上进行。根据阴阳极电子得失守恒的要求,这一变化过程中应该得到6个电子,导致产物中应该具有含有氧原子并带负电荷的粒子OH-。综合以上分析,可写出阴极上的电极反应式为6H2O+6e-
H2↑在阴极上进行。根据阴阳极电子得失守恒的要求,这一变化过程中应该得到6个电子,导致产物中应该具有含有氧原子并带负电荷的粒子OH-。综合以上分析,可写出阴极上的电极反应式为6H2O+6e- 3H2↑+6OH-。
3H2↑+6OH-。
(2)组成一个电解池需要直流电源、电解质溶液、导线、电源、容器等。
