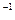问题
计算题
已知某混合气体的成分按体积分数计算是:80.0% CH4、15.0% C2H4和5.00% C2H6。试计算:
(1)0.500 mol该混合气体的质量。
(2)该混合气体在标准状况下的密度。
答案
(1)9.25 g(2)0.826 g·L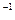
(1)根据在同温、同压下, ,故混合气体各成分的体积分数等于物质的量的百分组成,则有:
,故混合气体各成分的体积分数等于物质的量的百分组成,则有:
m(CH4)=n(CH4)·M(CH4)
="0.500" mol×80.0%×16 g·mol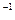 ="6.4" g
="6.4" g
同理:m(C2H4)="2.1" g,m(C2H6)="0.75" g。
所以,m(混)=m(CH4)+m(C2H4)+m(C2H6)="6.4" g+2.1 g+0.75 g="9.25" g
(2)按0.500 mol混合气体计算,
V(混)=n·Vm="0.500" mol×22.4 L·mol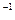 ="11.2" L。
="11.2" L。
所以,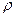 (混)=m(混)/V(混)="9.25" g/11.2 L="0.826" g·L
(混)=m(混)/V(混)="9.25" g/11.2 L="0.826" g·L