电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,若用硫酸铜溶液作电解液,粗铜接电源 极,电极反应为 ;通电一段时间后,溶液中铜离子浓度将 (增大,不变,减少)。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总离子反应
式为 ;电解时所需的精制食盐水,通常在粗盐水
加入某些试剂(现提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液来、BaCl2
溶液、Ba(NO3)2溶液、盐酸)除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,选出试剂,
按滴加的先后顺序为 (填所加试剂的化学式)。
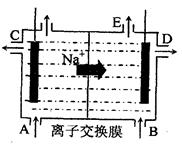
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离
子交换膜法电解饱和食盐水原理示意图。
|
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阴极溶液中加适量盐酸,可以恢复到电解前的物质的浓度
(1)正 Cu-2e-=Cu2+; 阴 Cu2++2e-=Cu
(2)2NaCl+2H2O 2NaOH+H2↑+Cl2↑;BaCl2,Na2CO3,NaOH,HCl(Na2CO3必须放在BaCl2后,盐酸须放在最后,其他顺序可变)
(3)ABC
(1)粗铜精炼时,铜失电子,作阳极,故粗铜与电源的正极相连。由于阴极只有铜
离子析出,而阳极除了铜失电子,还有锌失电子,故溶液中铜离子浓度将少。
(2)除杂的原则是除去原有杂质,并且不引入新杂质。要除去氯化钠中含有的Ca2+、Mg2+、
Fe3+、SO42-等,除去Mg2+、Fe3+可以加入氢氧化钠,二者均生成沉淀,除去SO42-加入
过量的氯化钡,不能加入Ba(NO3)2,否则会引入硝酸根离子,加入稍过量碳酸钠,除
Ca2+和少过量的Ba2+,最后加入盐酸除去过量的碳酸根离子和氢氧根离子。
(3)由Na+移动方向判断E为阴极,产生NaOH和H2,A正确;据电解总反应式可知2NaOH—Cl2,计算C正确;D项中,应通入HCl气体,若加入盐酸会增加水的量,故D项错。