(8分)(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为 mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为 mol/L。
(2) 4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
①放出的H2在标准状况下的体积为4.48L。②被还原出铜的质量为12.8g
③反应后溶液中Mg2+和H+物质的量浓度之比为2∶1
(1)11.7,2.52(或2.5或2.515)
(2)①解: Mg + 2HCl = MgCl2 + H2↑
24g 2mol 1mol 22.4L
4.8g n(HCl) n(MgCl2) V(H2)
∵n(HCl)=0.4mol<0.2L×2.52mol/L
∴盐酸过量,以Mg的量计算
V(H2)=4.48L n (MgCl2)=" 0.2mol " ②解:CuO + H2 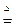 Cu + H2O
Cu + H2O
22.4L 64g
4.48L m(Cu)
m(Cu)=12.8g
③解: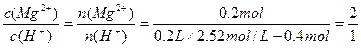
(若分别算出两种离子的物质的量或物质的量浓度得1分)
