如右图所示,常温,U形管内盛有100mL的某种溶液,
请按要求回答下列问题。
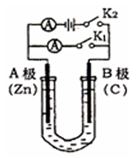
(1)若所盛溶液为CuSO4溶液,打开K2,合并K1,则:
① A为 极,B极的电极反应式为 。
②反应过程中,溶液中SO42-和OH-离子向 极(填:A或B)
移动。
(2)若所盛溶液为滴有酚酞的NaCl溶液,打开K1,合并K2,则:
①A电极可观察到的现象是 。
②电解过程总反应的化学方程式是 。
③反应一段时间后打开K2 ,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(折算成标准状况)为11.2mL,将溶液充分混合,溶液的pH为 。
④向电解后的电解质溶液中加入或通入 (填试剂名称),能使溶液复原。
(1)①负、Cu2++2e-=Cu ②A
(2)①产生气泡,电极附近溶液变红。②2NaCl+2H2O 2NaOH+H2↑+Cl2↑。③ 12
2NaOH+H2↑+Cl2↑。③ 12
④氯化氢
(1)①负、Cu2++2e-=Cu ②A
解析:打开K2,合并K1,形成原电池,A是锌,是活泼金属,作负极,B为正极,得电子,电极反应为Cu2++2e-=Cu;②负电荷移向负极,溶液中SO42-和OH-离子向A极移动。
(2)①产生气泡,电极附近溶液变红。②2NaCl+2H2O 2NaOH+H2↑+Cl2↑。③ 12
2NaOH+H2↑+Cl2↑。③ 12
④氯化氢
解析:(2)打开K1,合并K2,形成电解池,A为阴极,2H2O+2e-=H2+2OH― ,可观察到的现象是①产生气泡,电极附近溶液变红。②电解过程总反应的化学方程式是2NaCl+2H2O 2NaOH+H2↑+Cl2↑。③B极产生Cl2,11.2mL/22400ml·mol-1=0.0005mol,由方程式,产生0.001molNaOH ,c(NaOH)=0.001mol/0.1L=0.01mol / L,pH="14+lg0.01" ="12"
2NaOH+H2↑+Cl2↑。③B极产生Cl2,11.2mL/22400ml·mol-1=0.0005mol,由方程式,产生0.001molNaOH ,c(NaOH)=0.001mol/0.1L=0.01mol / L,pH="14+lg0.01" ="12"
④由方程式可知加入氯化氢,能使溶液复原。
