问题
问答题
实验小组用如下的装置进行实验.
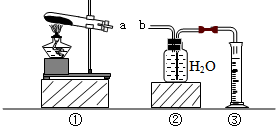
| 实 验 步 骤 | 简 答 |
| 第一步:称取4.9g氯酸钾与少量二氧化锰混合后放入装置①的试管中,点燃酒精灯. | 装置①的试管中发生反应的化学方程式:______ |
| 第二步:加热试管一段时间后,用橡皮管连接a、b. | 刚开始加热时,排出的气体不宜立即收集,原因是______. |
| 第三步:当装置②中水面不再下降,断开a、b,移去酒精灯,将装置②中的集气瓶密封,并贴上标签备用. | |
| 第四步:读取量筒里水的体积数并记录. | 读数时,视线必须与液体凹液面的______保持水平. |
| 问题与解析 | 问题一:在理解上述实验的基础上,请你归纳本实验的目的______ |
| 问题二:最能说明这个反应已完成的实验现象是______ | |
| 问题三:该实验最多能制取氧气的质量是______ 克. |
答案
第一步:氯酸钾受热分解的化学方程式为:2KClO3
2KCl+3O2↑.MnO2 . △
第二步:刚开始加热时,排出的气体不宜立即收集,原因是:刚冒出的气体中含有空气.故填:刚冒出的气体中含有空气.
第四步:读取量筒里水的体积数时,视线必须与液体凹液面的最低处保持水平.故填:最低处.
实验目的:该实验的主要目的是测定生成氧气的体积.故填:测定产生氧气的体积.
最能说明这个反应已完成的实验现象是:量筒内液面不再上升.故填:量筒内液面不再上升.
4.9g氯酸钾与少量二氧化锰混合,假设4.9g混合物都是氯酸钾,则生成氧气的质量最多;
氯酸钾中的氧元素完全转化成了氧气,即氯酸钾中氧元素的质量就是生成氧气的质量,4.9g氯酸钾中氧元素的质量为:4.9g×
×100%=1.92g,即生成氧气的质量最多是1.92g.48 122.5
故填:1.92.
