问题
问答题
实验室常用过氧化氢(H2O2)溶液和MnO2粉末来制取氧气,该反应能迅速分解生成O2和H2O.
(1)在该反应中二氧化锰的作用______
(2)写出该反应的化学反应方程式______
(3)制取1mol氧气需过氧化氢______mol
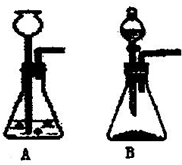
(4)若将A装置改为B装置,比较B装置与A装置的不同及优势______.
答案
(1)在该反应中二氧化锰做催化剂,起催化作用;
(2)过氧化氢和二氧化锰混合反应生成水和氧气,化学反应方程式2H2O2
2H2O+O2↑; MnO2 .
(3)化学反应方程式2H2O2
2H2O+O2↑,可知制取1mol氧气需过氧化氢2mol; MnO2 .
(4)比较发生装置的优点可知,B装置可以控制加入的双氧水的量,进而控制反应的停止或发生.
故答案为:(1)催化作用;(2)2H2O2
2H2O+O2↑;(3)2mol;(4)B装置可以控制加入的双氧水的量,进而控制反应的停止或发生. MnO2 .
