问题
问答题
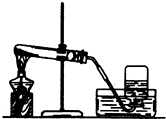
图是实验室利用氯酸钾和二氧化锰制取氧气的装置,回答下列问题:
a.该装置中收集氧气的方法是______,说明氧气具有______的性质;
b.吴勇同学欲制取0.36摩尔氧气,理论上需要氯酸钾多少摩尔?产生氯化钾多少摩尔?若使产生的氯化钾与硝酸银溶液完全反应,至少需要质量分数为20%的硝酸银溶液多少克?(提示:氯化钾与硝酸银溶液反应原理同盐酸与硝酸银溶液反应,写出计算过程).
答案
a、观察图示可知,是用排水法收集气体,说明氧气不易溶于水.
故答案为:排水集气法;不易溶于水.
b、设理论上需要KClO3的物质的量为x,生成的KCl的物质的量为y.
2KCOl3
2KCl+3O2↑MnO2 . △
2 2 3
x y 0.36mol
=2 3 x 0.36mol
=2 3 y 0.36mol
解得:x=0.24mol,y=0.24mol
设需要AgNO3的物质的量为z.
KCl+AgNO3═AgCl↓+KNO3
1 1
0.24mol z
=1 1 0.24mol z
z=0.24mol 至少需要质量分数为20%的硝酸银溶液的质量为:
0.24 mol×170g/mol÷20%=204g
答:理论上需要氯酸钾0.24摩尔.产生氯化钾0.24摩尔.至少需要质量分数为20%的硝酸银溶液的质量为204g.
