(12分)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
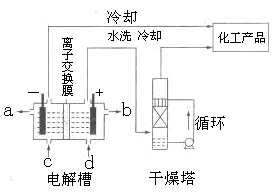
(1)下图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ;NaOH溶液的出口为 (填字母);精制饱和食盐水的进口为 (填字母);干燥塔中应使用的液体是 。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
① SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为 。
② SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为 ______kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气 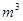 (标准状况)。
(标准状况)。
(1)阳极产生的气体是氯气;NaOH溶液的出口为a(填字母);精制饱和食盐水的进口为d(填字母);干燥塔中应使用的液体是浓硫酸。
(2)①化学方程式为SiCl4+2H2+O2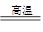 SiO2+4HCl。
SiO2+4HCl。
②理论上需消耗纯NaCl的质量为0.35kg。
(3)生成氢气134.4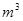 (标准状况)。
(标准状况)。
分析:(1)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,要干燥Cl2需要用酸性干燥剂或中性干燥剂.
(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可;
②利用三段分析法,根据平衡时H2与SiHCl3物质的量浓度,求出的起始物质的量,再根据2NaCl+2H2O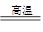 Cl2↑+H2↑+2NaOH,求出理论上消耗纯NaCl的质量;
Cl2↑+H2↑+2NaOH,求出理论上消耗纯NaCl的质量;
(3)根据得失电子守恒,NaCl转化为NaClO3所失去的电子等于H2O转化为H2所得到的电子,由氯酸钠的质量求出氯酸钠的物质的量,进而求出NaCl转化为NaClO3所失去的电子的物质的量,最后求出生成氢气在标准状况下的体积.
解答:解:(1)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,
阳极:2Cl--2e-═Cl2↑,
阴极:2H++2e-═H2↑;
总反应为:2NaCl+2H2O Cl2↑+H2↑+2NaOH,
Cl2↑+H2↑+2NaOH,
阴极:氢离子放电,产生氢气.致使氢氧根离子浓度增大,钠离子和氢氧根离子的增大都发生在阴极室,所以a出口导出的液体是氢氧化钠溶液;
阳极:氯离子放电,产生氯气,致使钠离子浓度升高,通过阳离子交换膜到达阴极室.所以d入口应加入精制饱和食盐水;
要干燥Cl2需要用酸性干燥剂浓硫酸或P2O5等,中性干燥剂无水CaCl2.
(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可.
发生的化学方程式为:SiCl4+2H2+O2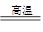 SiO2+4HCl;
SiO2+4HCl;
②由3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 2x x 4x
平衡量(mol) n-2x 4x
4x=0.020mol/L×20L=0.4mol,x=0.1mol,
n-2x=0.140mol/L×20L=2.8mol,n=3.0mol,
由2NaCl+2H2O Cl2↑+H2↑+2NaOH,
Cl2↑+H2↑+2NaOH,
2mol 1mol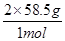 =
=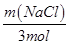 ; m(NaCl)=351g=0.351kg.
; m(NaCl)=351g=0.351kg.
(3)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,
设产生的H2体积为Vm3,
由得失电子守恒得:6×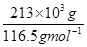 =2×
=2×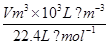 ;
;
V=134.4m3.
故答案为:(1)①氯气;a;d;浓硫酸;
(2)①SiCl4+2H2+O2 SiO2+4HCl;②0.351;
SiO2+4HCl;②0.351;
(3)134.4.
点评:本题考查电解、氯碱工业、化学平衡的计算、化学方程式书写、化学计算等知识.
