(16分)
(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用_(填“氧化剂”或“还原剂”)与之反应。
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法:

(3)酸浸法制取硫酸铜的流程示意图如下

① 步骤(i)中Cu2(OH) 2CO3发生反应的化学方程式为 。
② 步骤(ii)所加试剂起调节pH 作用的离子是 (填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为 。
④ 步骤(iv)除去杂质的化学方程式可表示为
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +
过滤后母液的pH =" 2.0" , c (Fe3+) ="a" mol·L-1,, c ( NH4+)="b" mol·L-1,, c ( SO42-)=" d" mol·L-1,该反应的平衡常数K=_ (用含a 、b 、d 的代数式表示)。
(1) 负
(2) ①还原剂 ②调节溶液pH在8~9之间
(3)① Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O。
② HCO3- 。
③MnO2+2Fe2++4H+ Mn2++2Fe3++2H2O。
Mn2++2Fe3++2H2O。
④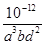
(1)电镀时,待镀件与电源的负极相连,溶液中的镀层金属离子得到电子在镀件上析出。
(2) ①②化学电镀的原理就是利用置换反应将镀层金属离子从溶液中置换出来,从铜盐中置换出铜通常用Fe等还原剂。②由图可看出溶液pH低于9时,该化学镀的反应速率为0,因此可调节pH略小于9即可使反应停止。
(3)①Cu2(OH)2CO3溶于H2SO4的反应为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O。
②加入的NH4HCO3中的NH4+ 水解显酸性,HCO3- 水解显碱性,且可以与溶液中的H+反应,故起调节pH作用的离子是HCO3- 。
③溶液中具有还原性的只有Fe2+,再根据1molMnO2转移2mol电子,即可写出相应的离子方程式为MnO2+2Fe2++4H+ Mn2++2Fe3++2H2O。
Mn2++2Fe3++2H2O。
④化学平衡常数就是达到化学平衡时,生成物浓度幂之绩与反应物浓度幂之绩的比值,注意溶液中的沉淀和水的浓度看作是1。
考点定位:本题考查了电镀原理、化学平衡的应用和物质的制备。
