某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
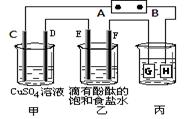
(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 ;
(4)在常温下,现用丙装置给铁镀铜,则H电极材料应该是 ,
当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(5)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
(1)负极 (2) 2H+2e-=H2↑ (3) 2:1:2:2 (4) 铜 13
(5)CuO(若考虑到水开始电解Cu(OH)2也可以)
考查电化学的应用。
(1)C电极表面有铜析出,说明C是阴极,所以A是电源的负极,B是正极H、F、D都是阳极,G和E是阴极。
(2)E是阴极,根据离子的放电顺序可知,溶液中的氢离子放电,反应式为2H+2e-=H2↑。
(3)根据离子的放电能量可判断,C、D、E、F电极产生的单质铜、氧气、氢气和氯气。根据电子的得失守恒可知,四种单质的物质的量之比是2:1:2:2。
(4)电镀时镀层金属作阳极,待镀金属作阴极,含有镀层金属离子的溶液作电镀液,H是阳极,所以电极材料是铜。3.2g铜转移电子是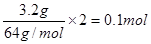 ,所以乙中生成的氢氧化钠是0.1mol,浓度是0.1mol/L,则pH=13。
,所以乙中生成的氢氧化钠是0.1mol,浓度是0.1mol/L,则pH=13。
(5)甲中的电解产物是铜、氧气和硫酸,所以要使溶液恢复到原来的浓度,应该加入氧化铜。