(10分)某研究性学习小组用电解 溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16。请回答:
溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16。请回答:
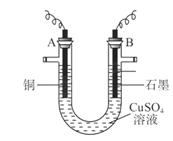
(1)m g应为 极的质量增重(填A或B),电解总反应的离子方程式为 ;
(2)本实验(电解 溶液)中,学习小组采用两套方案测定铜的相对原子质量。
溶液)中,学习小组采用两套方案测定铜的相对原子质量。
①第一套方案中,同学们测得气体的体积为V L(标准状况),则铜的相对原子质量是(用m、V表示) ;
②第二套方案中,以下数据需要测定的是(填序号) 。
a. A极增加的质量 b. 整套装置减少的质量
c. 电解后溶液的体积 d. 电解后溶液的pH(可由此计算出溶液中H+的物质的量浓度)
(1)A 2CuSO4+2H2O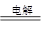 2Cu+2H2SO4+O2↑ (2) ①
2Cu+2H2SO4+O2↑ (2) ①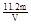 ②ab或acd
②ab或acd
(1)析出的金属应该是铜,所以应该在阴极,即在A电极析出;石墨是阳极,溶液中的OH-放电,所以总的方程式是2CuSO4+2H2O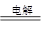 2Cu+2H2SO4+O2↑。
2Cu+2H2SO4+O2↑。
(2)①VL是氧气的体积,在氧气的物质的量是V/22.4mol。因此根据方程式可知,生成铜是V/11.2mol。所以铜的相对原子质量是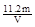 。
。
②要计算铜的相对原子质量,则需要计算析出铜的质量和铜物质的量。根据方程式可知,要计算铜的物质的量,可以通过溶液减少的质量来计算生成的氧气质量;或者通过计算生成的硫酸的物质的量,因此正确的答案是ab或acd。
