(8分)氯碱工业中电解饱和食盐水的原理示意图如下图所示:
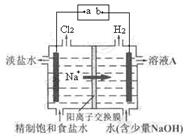
(1)电极a是电源的 。
(2)溶液A的溶质是(填化学式) 。
(3)电解饱和食盐水的离子方程式是 。
(4)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 _______________________________________________________ 。
(5)电解所用的盐水需精制,去除盐水中的Ca2+、Mg2+、NH4+和SO42-,提供的试剂有① Na2CO3溶液② BaCl2 溶液③ NaOH溶液④ HCl,加入试剂的顺序是________________。
(1)正极(1分)(2)NaOH (1分)
(3)2Cl-+2H2O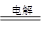 2OH-+H2↑+Cl2↑(2分)
2OH-+H2↑+Cl2↑(2分)
(4)氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。(2分)
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。(2分)
(5)②③①④或③②①④(2分)
(1)惰性电极电解饱和食盐水,阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,所以a是正极,b是负极。
(2)阴极氢离子放电,破坏了阴极周围水的电离平衡,所以阴极周围溶液显碱性,产生氢氧化钠。
(3)离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
(4)由于阳极生成氯气,而氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出。
(5)Ca2+用CO32-,Mg2+、NH4+用OH-,SO42-用Ba2+,过量的Ba2+需要用CO32-,所以正确的顺序是②③①④或③②①④。
