工业上以黄铜矿为原料,采用火法熔炼工艺生产粗钢。
(1)该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(2)火法熔炼的粗铜含杂质较多。某化学研究性学习小组在实验室条件下用CuSO4溶液作电解液来实现粗铜的提纯,并对电解后溶液进行净化除杂和含量测定。
实验一 粗铜的提纯粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应),电解时粗铜应与电源的 极相连,阴极上的电极反应式为 。
实验二 电解后溶液的净化除杂在精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学参考下表的数据,设计了如下方案:

试剂a是 (填化学式),其目的是 ;该方案能够除去的杂质离子是 (填离子符号)。
实验三 电解后溶液离子含量的测定
乙同学设计了如下方案:
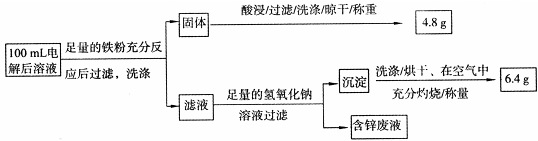
则100mL溶液中Cu2+的浓度为 mol·L-1,Fe2+的浓度为 mol·L-1。
(14分)
(1)Cu2O 、Cu2S (2分);
(2)正(1分) Cu2++2e-= Cu(2分) H2O2(2分)将Fe2+氧化成Fe3+(2分) Fe2+ (2分)
0.75(2分)0.05(2分)
题目分析:
(1)反应中Cu2O 、Cu2S的Cu均从+1→0价,所以反应的氧化剂Cu2O 、Cu2S。
(2)精炼铜时粗铜做阳极与电源的正极相连,电极反应:Cu2++2e-= Cu。根据流程中调节pH到4可知三价铁沉淀,试剂a是氧化剂,将Fe2+氧化成Fe3+,除去Fe2+。固体为铁和铜的混合物,酸处理后的4.8g为铜,n(Cu)=4.8/64g/mol=0.075mol,c(Cu2+)=0.75 mol·L-1;根据题意生成m(Fe2O3)=6.4g,n(Fe2O3)=6.4g/160g/mol=0.04mol,得n(Fe)=0.08mol;其中来自与硫酸铜的置换反应的为0.075mol,所以原溶液中n(Fe)=0.005mol,Fe2+的浓度为0.05 mol·L-1。
