(10分)如图为相互串联的甲乙两个电解池,请回答:
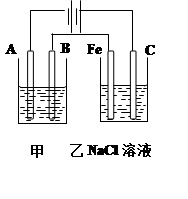
甲池若为用电解精炼铜的装置:
(1)A极电极反应为 ,
B极电极反应为_ _,
乙池中的总反应离子方程式为 。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为 。
(3)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为 。
(10分) (1) Cu2+ + 2e–== Cu ; Cu -2e–="=" Cu2+
2Cl- + 2H2O 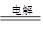 Cl2↑ + 2OH- + H2 ↑ (2) 4.48L (3) 1 mol·L-1
Cl2↑ + 2OH- + H2 ↑ (2) 4.48L (3) 1 mol·L-1
题目分析:(1)A极与电源的负极训练,做阴极,所以连接的是纯铜,则电极反应式为Cu2+ + 2e–== Cu;二B电极就是阳极,连接的是粗铜,电极反应式是Cu -2e–="=" Cu2+。乙池中C电极是阳极,铁是阴极,电解饱和食盐水,则总的离子方程式是2Cl- + 2H2O 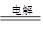 Cl2↑ + 2OH- + H2 ↑。
Cl2↑ + 2OH- + H2 ↑。
(2)甲槽阴极增重12.8g,则析出铜是12.8g,物质的量是0.2mol,转移电子是0.4mol。则根据电子的得失守恒可知,乙槽阴极放出氢气体积是0.2mol×22.4L/mol=4.48L。
(3)根据(2)可知,氢气是0.2mol,则生成氢氧化钠是0.4mol,物质的量浓度是0.4mol÷0.4L=1.0mol/L。
点评:该题是基础性试题的考查,试题基础性强,侧重考查灵活运用基础知识解决实际问题的能力。该题难度不大,关键是要熟练掌握电化学原理,学生不难得分。
