高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性。
(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol·L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示。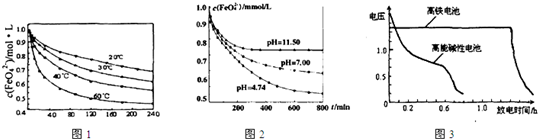
该实验的目的是_______________________;FeO42-发生反应的△H____________0(填“>”“<”或“=”)
(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol·L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图像见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是______________。
(3)电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明 。电解时阳极发生反应生成FeO42-,该电极反应式为______________。
(4)与MnO2—Zn电池类似,K2FeO4—Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为_______________。图3为高铁酸钾电池和高能碱性电池放电曲线,由此可得出的高铁酸钾电池的优点有_______________________、________________________。
(1)探究温度对FeO42-影响(温度越高,高铁酸钾越不稳定),>(各2分)
(2)pH=11.50时溶液中OHˉ离子浓度大,不利于K2FeO4与水的反应正向进行。 (2分)
(3)同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小 (2分)
Fe+8OHˉ-6eˉ= FeO42-+4H2O (2分)
(4)3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ (2分)
放电时间长、工作电压稳定 (各1分)
题目分析:(1)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:温度越高,高铁酸钾越不稳定(或温度越高,高铁酸钾与水反应的速率越快);>
(2)由图2数据可知,溶液pH越小,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小.高铁酸钾在水中的反应为4FeO42-+10H2O 4Fe(OH)3 +8OH-+3O2↑,pH=11.50的溶液中OH-离子浓度大,使上述平衡向左移动,FeO42-浓度增大,不利于K2FeO4与水的反应正向进行;
4Fe(OH)3 +8OH-+3O2↑,pH=11.50的溶液中OH-离子浓度大,使上述平衡向左移动,FeO42-浓度增大,不利于K2FeO4与水的反应正向进行;
故答案为:pH=11.50的溶液中OH-离子浓度大,使上述平衡向左移动,不利于K2FeO4与水的反应正向进行;
(3)以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;阳极是铁失电子在碱性溶液中发生氧化反应生成FeO42-;电极反应为:Fe+8OHˉ-6eˉ=FeO42-+4H2O;
故答案为:同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小;Fe+8OHˉ-6eˉ=FeO42-+4H2O;
(4)原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O→Fe(OH)3 +5OHˉ;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2 +2Fe(OH)3 +4OHˉ;由图3知高铁电池比高能碱性电池放电时间长,工作电压稳定;
故答案为:3Zn+2FeO42-+8H2O=3Zn(OH)2 +2Fe(OH)3 +4OHˉ;放电时间长,工作电压稳定;
