由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐
溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所
示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石
墨和铁。
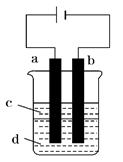
(1)a电极材料为 ,其电极反应式为 。
(2)若电解液d是 (填字母编号,下同),则白色沉淀在电极上生成;若是 ,则白色沉淀在两极之间的溶液中生成。
A.纯水
B.NaCl溶液
C.NaOH溶液
D.CuCl2溶液(3)液体c为苯,其作用是 ,在加入苯之前,要对d溶液进行 (填操作名称)处理,其目的是除去溶液中溶解的氧气。
(4)若装置中生成的气体在标准状况下的体积为2.24L,则生成的沉淀质量为 g。
(8分)
(1)Fe(1分) Fe-2e-===Fe2+(1分)
(2) C(1分) B(1分)
(3)隔绝空气,防止Fe(OH)2被氧气氧化;(1分) 加热(1分)
(4)9(2分)
题目分析:(1)a电极与电源正极相连,因而是铁,电极反应是Fe-2e-===Fe2+;
(2) A项,纯水几乎不能导电,D项铁与氯化铜不通电就反应,排除AD,B项,电解过程,溶液中逐渐有氢氧根产生,沉淀在溶液中产生,而C项,一开始就有氢氧根,沉淀在电极上产生,故答案分别是C和D;
(3)隔绝空气,防止Fe(OH)2被氧气氧化;加热除去溶解的氧气;
(4)结合方程式Fe-2e-===Fe2+和H2O+2e-===2OH-+H2↑,可知生成1molFe(OH)2,即9g。
点评:本题考查的Fe(OH)2性质及电解池的知识,题目难度不大,结合所学知识即可解答。
