过氧化氢(H2O2)溶液在MnO2做催化剂的条件下,能迅速分解生成O2和H2O.分液漏斗可以通过调节活塞控制液体的滴加速度.现欲制取干燥而纯净的氧气,可采用下图装置:回答下列问题:
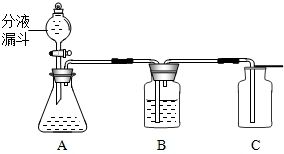
(1)分液漏斗中盛放的物质是______;
(2)装置B中的药品是______;
(3)A中发生的反应化学方程式是______;
(4)用该实验代替加热KMnO4制取O2,优点是______(填序号)①生成物只有氧气②不需加热③生成氧气多
(5)如果要确认C中气体已经干燥,则需在B和C之间连接一个U型管,U型管中应放的物质为______.
(6)若改变装置A中的药品,此套装置还可以用来制取______气体.
(1)分液漏斗应加入液体物质:过氧化氢溶液 或 H2O2,锥形瓶里应先放人固体物质:二氧化锰 或 MnO2;
(2)干燥氧气、氢气、二氧化碳等气体用浓硫酸作干燥剂;
(3)A中反应,双氧水在二氧化锰作用下生成水和氧气,化学方程式为:2H2O2
2H2O+O2↑; MnO2 .
(4)物质制取方法的选择、优劣的判断,一般原则是:原料是否丰富、廉价;消耗能源的多与少;制取过程中是否给环境带来污染等;实验时用此法代替高锰酸钾加热制取氧气优点是不需加热;
(5)用无水硫酸铜来验证水的存在;
(6)此装置为“固液不加热”装置,此装置还可以制取二氧化碳.
故答案为:
(1)过氧化氢(或双氧水、H2O2)
(2)浓硫酸
(3)2H2O2
2H2O+O2↑ MnO2 .
(4)②
(5)无水硫酸铜
(6)二氧化碳(或CO2)
