某化学兴趣小组拟采用下图所示装置电解饱和氯化钠溶液制备H2,通过H2还原氧化铜测定Cu的相对原子质量Ar(Cu),同时检验Cl2的氧化性(图中夹持和加热仪器已略去)。
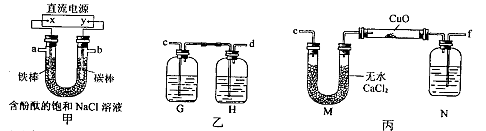
(1)直流电源中的X极为 极(填“正”、“负”、“阴”或“阳”);写出甲装置U形管中反应的离子方程式: ;实验开始后,用铁棒作电极的一侧的实验现象是 。
(2)为完成上述实验,正确的链接顺序为:a连 ,b连 (填写连接的字母)。
(3)装置乙中的G瓶内溶液可能为 (填字母)。
A.淀粉KI溶液
B.NaOH溶液
C.Na2S溶液
D.Na2SO3溶液H瓶内的反应的离子方程式为: 。
(4)在对硬质玻璃试管里的氧化铜粉末加热前需要进行的操作为: 。
(5)装置丙中N瓶内盛放的试剂为 ,作用是 。
(6)为了测定Cu的相对原子质量,某同学通过实验测得如一下数据:
I.氧化铜样品质量为m1g
Ⅱ.反应后硬质玻璃管中剩余固体质量为m2g
Ⅲ.反应前后U形管及其固体质量差为m3g
Ⅳ.反应前后瓶及其液体质量差为m4g
①请选择理论上误差最小的一组数据计算Ar(Cu),Ar(Cu)= 。
②如果选用其它数据进行计算,会导致Ar(Cu) (填“偏大”、“偏小”或“无影响”),理由是 。
(1)负极;2Cl-+2H2O 2OH-+Cl2↑+H2↑; 有气泡逸出,溶液由无色变成红色,且向周围扩散。
2OH-+Cl2↑+H2↑; 有气泡逸出,溶液由无色变成红色,且向周围扩散。
(2)f; c
(3)A、C;Cl2+2OH-=Cl-+ClO-+H2O
(4)检验H2的纯度防止爆炸
(5)浓硫酸;干燥H2,防止硬质试管炸裂
(6)①16m2/(m1-m2);②偏小;空气中的水通过e导管进入U型管造成m3增大,最终导致Ar(Cu)偏小。
(1)根据电解原理,与阴极相连的是外接电源的负极,故X极应为负极。甲中电解饱和食盐水,化学方程式为
2NaCl+2H2O 2NaOH+Cl2↑+H2↑改写为离子方程式即可。铁棒做阴极,电极反应是2H2O+2e-=2OH-+H2↑,放出H2,原溶液含有酚酞,变成红色。
2NaOH+Cl2↑+H2↑改写为离子方程式即可。铁棒做阴极,电极反应是2H2O+2e-=2OH-+H2↑,放出H2,原溶液含有酚酞,变成红色。
“通过H2还原氧化铜测定Cu的相对原子质量Ar(Cu)”故a接f;“同时检验Cl2的氧化性”,故b接c。
A、C、D中的I-、S2-、SO32-都有还原性,但是Cl2与SO32-反应没有现象,故选A、C。
Cl2+2NaOH=NaCl +NaClO+H2O。
(4)检验H2的纯度防止爆炸。
(5)浓硫酸;干燥H2,防止硬质试管炸裂。
(6)①CuO+H2=Cu+H2O △m=80-64=16,现在质量差为m1-m2,而“反应后硬质玻璃管中剩余固体质量为m2g”,即Cu的质量为m2g。根据化学方程式就可求出Ar(Cu)。②偏小;空气中的水通过e导管进入U型管造成m3增大,最终导致Ar(Cu)偏小。
