问题
选择题
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
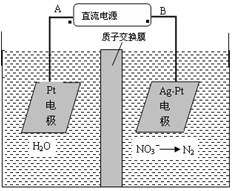
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
答案
答案:C
题目分析:本题考查电解原理的应用,利用反应类型定极,由题给原理图知,Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,电极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,则B为负极,A为电源正极,Pt电极为电解池的阳极,电极反应式为:2H2O-4e-=4H++O2↑;A、根据题给原理图知,在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极,正确;B、阳极为溶液中的氢氧根放电,氢氧根来自水的电离,电极反应式为:2H2O-4e-=4H++O2↑,正确;C、由阳极电极反应式知,转移2mol电子时,阳极区消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=14.4g,错误;D、阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-,正确。
