科学地补充碘可防止碘缺乏病。
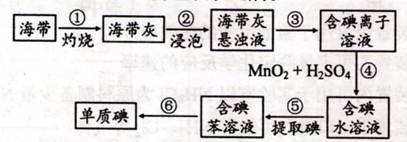
(1)上图为海带制碘的流程图。步骤③的实验操作中用到的玻璃仪器除了烧杯、玻璃棒之外还有 ;当步骤④反应中转移0.2mol电子时生成碘的质量:
(2)碘酸钾(KIO3)是食盐的加碘剂。KIO3在酸性介质中能与H2O2或I-作用均生成单质碘。
请回答下列问题:
①以碘为原料,通过电解制备碘酸钾的实验装置如图所示。电解前,将一定量的精制碘溶于过量氢氧化钾溶液,溶解是发生反应为:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区。电解时,阳极反应: I-+6OH--6e-=IO3-+3H2O,当外电路上通过3mol电子时(碘离子被完全消耗),溶液中的IO3-的物质的量是 ;阴极上产生的气体在标准状况下的体积: 。
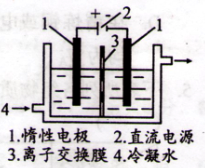
②电解过程中,需通过检验阳极电解液中是否有I-存在以确定电解是否完成。请设计判断电解是否完成的实验方案,并填人下表。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
| 实验操作 | 实验现象及结论 |
(共12分)
(1)漏斗(2分);25.4 g(2分)
(2)①0.6mol(2分) 33.6 L(2分)
②
| 实验操作 | 实验现象及结论 |
| 取少量阳极区电解液于试管中,(1分)加稀硫酸酸化后加入几滴淀粉试液,(1分)观察是否变蓝 | 如果不变蓝,说明无I-(如果变蓝,说明有I-)(2分) |
题目分析:
(1)从悬浊液中分离,采用过滤的方法,故还需使用漏斗;第④步发生的反应为2I-+MnO2+4H++=I2+Mn2++2H2O;
(2)IO3-的来源为两部分,①3I2+6KOH=5KI+KIO3+3H2O,② I-+6OH--6e-=IO3-+3H2O,故总量为0.1+0.5=0.6mol;阴极发生反应为2H++2e-=H2,故产生标况下H233.6L。
(3)I-检验可以转化为碘单质检验,遇淀粉变蓝色,因溶液中有碘酸根,故直接酸化后用归中反应得到。
