回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
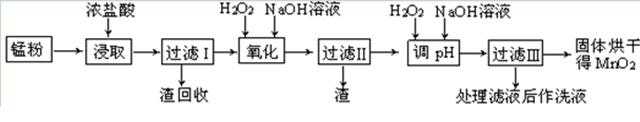
根据上图所示步骤并参考表格数据,回答下列问题。
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程方程式: _。
(2)酸浸时,浸出时间对锰浸出率的影响如下图所示,工业采用的是浸取60 min,其可能原因是 。

(3)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是 。
(4)过滤I所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是 。
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+ 氧化得到MnO2,反应的离于方程式为 。
(6)工业上利用KOH和MnO2为原料制取KMnO4。主要生产过程分两步进行:第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌以制取K2MnO4;第二步为电解K2MnO4的浓溶液制取KMnO4。
① 第一步反应的化学方程式为 。
② 电解K2MnO4的浓溶液时,电解池中阴极的实验现象为 。
(1)MnO2 + 4H+ + 2Cl- =Mn2+ + Cl2↑+ 2H2O(3分)
(2)60min后,再延长浸出时间,增加生产成本,而浸出的量不明显;(2分)
(3)将Fe2+转化为Fe3+(2分)
(4)使Fe3+完全转化为Fe(OH)3沉淀,并防止Mn2+变成Mn(OH)2(2分)
(5)Mn2+ + H2O2 + 2OH- = MnO2↓+2H2O(3分)
(6)2MnO2 + 4KOH + O2= 2K2MnO4 + 2H2O(2分);产生无色气泡(2分)
题目分析:(1)用浓盐酸浸取锰粉后所得溶液含有Mn2+ ,所以MnO2与浓盐酸发生了氧化还原反应,结合学过的实验室制氯气的实验可知MnO2与浓盐酸反应的离子方程式为MnO2 + 4H+ + 2Cl- =Mn2+ + Cl2↑+ 2H2O。
(2)从浸出率和时间图像可以看出,开始随着时间增大,浸出率相应增大,过了60min后浸出率开始下降,随后又上升,但是浸出率与60min时相比变化不大,所以工业采取的浸出时间最好是60min,这样既能使浸出率较高,又能节约成本。
(3)过滤I除去不溶杂质后,溶液中含有大量Fe2+ 杂质,所以加入足量H2O2溶液使Fe2+ 转化Fe3+ 从而完全沉淀除去。
(4)因为Fe3+ 完全沉淀的pH值为3.7,而溶液中Mn2+ 开始沉淀的pH为8.3,所以沉淀Fe3+的同时不能让Mn2+ 沉淀,所以要控制pH值约为5.1。
(5)该氧化还原反应离子方程式书写要注意反应的环境为碱性环境,有OH-参加,所以判断出氧化剂和还原剂以及产物后不难得出离子方程式为Mn2+ + H2O2 + 2OH- = MnO2↓+2H2O。
(6)制备高锰酸钾第一步中,Mn的化合价由+4→+6价,被氧化,所以MnO2 作还原剂,反应中有氧气参与反应,所以根据得失电子守恒配平的方程式为:2MnO2 + 4KOH + O2= 2K2MnO4 + 2H2O。
