问题
选择题
200C时,饱和NaOH溶液的密度为1.458g/cm3,物质的量浓度为3.5mol/L ,则下列说法正确的是 ( )
A.此饱和溶液中NaOH的质量分数为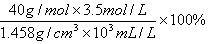
B.250C时,饱和NaOH的物质的量浓度为3.5mol/L
C.200C时,向饱和NaOH溶液中加入金属钠(2Na+2H2O==2NaOH+H2↑),恢复到200C时则溶液的质量分数变大
D.将此溶液蒸发部分水,再恢复到200C时,溶液密度一定大于1.458g/cm3
答案
答案:A
A正确,溶质的质量分数与物质的量浓度的关系为: ;所以可得饱和溶液中NaOH的质量分数为
;所以可得饱和溶液中NaOH的质量分数为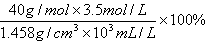 ;B错,氢氧化钠的溶解度随温度的升高而增大,所以,250C时,饱和NaOH的物质的量浓度大于3.5mol/L;C错,200C时,向饱和NaOH溶液中加入金属钠(2Na+2H2O==2NaOH+H2↑),恢复到200C时则溶液仍为饱和溶液,溶液的质量分数不变;D错,将此溶液蒸发部分水,再恢复到200C时,溶液有为饱和溶液,溶液密度仍等于1.458g/cm3
;B错,氢氧化钠的溶解度随温度的升高而增大,所以,250C时,饱和NaOH的物质的量浓度大于3.5mol/L;C错,200C时,向饱和NaOH溶液中加入金属钠(2Na+2H2O==2NaOH+H2↑),恢复到200C时则溶液仍为饱和溶液,溶液的质量分数不变;D错,将此溶液蒸发部分水,再恢复到200C时,溶液有为饱和溶液,溶液密度仍等于1.458g/cm3
