问题
计算题
在A容器中盛有80%的H2和20%的O2(体积分数)的混合气体,试求:
(1)其中H2与O2的分子数之比是多少?质量比是多少?
(2)混合气体的平均式量多少?混合气体在标准状况下的密度是多少?
(3)在某温度(高于100℃)时,引燃A容器中的气体,回复到原来温度,则A容器内混合气体的平均式量是多少?引燃前后,A容器内压强如何变化?A容器内混合气体的密度是否变化?
答案
(1)1∶4(2)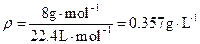 (3)压强减小密度不变
(3)压强减小密度不变
(1)H2与O2的分子数之比= 80%∶20%= 4∶1
H2与O2的质量之比 = 4×2∶1×32 =1∶4
(2)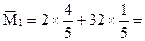 8
8 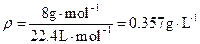
(3)设 n(H2)=" 4" mol n(O2)="1" mol (不足) n总 =" 5" mol
反应后 n’(H2)=" 2" mol n(O2)=" 0" mol n(H2O)(g)="2" mol n总=" 4" mol
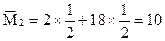
因为n(g)减小,所以压强减小。
因为V总不变,m总不变,,所以密度不变。
21.1 mol该烃含氢量=(7.2 g/18 g
