电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)如图为电解精炼银的示意图,________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。
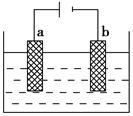
AgNO3—HNO3溶液
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列问题:
①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol。
③电解过程中有Fe(OH)3沉淀生成,原因是___________________________。
(3)电解降解法可用于治理水中硝酸盐的污染。电解降解NO3-的原理如图所示。
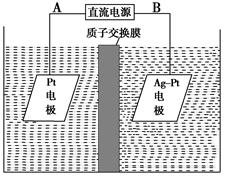
电源正极为________(填A或B),阴极反应式为______________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。
(1)a NO3-+3e-+4H+=NO↑+2H2O或NO3-+e-+2H+=NO2↑+H2O
(2)①2H++2e-=H2↑ Fe-2e-=Fe2+ ②6 ③阳极生成的Fe2+被溶液中的Cr2O72-氧化Fe3+,阴极H+放电,随着溶液中的酸性下降,使Fe3+的水解平衡右移,生成Fe(OH)3沉淀
(3)①A 2NO3-+6H2O+10e-=N2↑+12OH- ②14.4
(1)电解精炼时,不纯金属作阳极,即为a极;b电极是阴极,NO3-发生还原反应,生成了NO,遇空气氧化生成红棕色的NO2。(2)根据电解原理,该电解法的阳极反应为Fe-2e-=Fe2+,生成的亚铁离子被溶液中的
Cr2O72-氧化:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原,得到2 mol Cr(OH)3。氢离子浓度减小,随着溶液中的酸性下降,Fe3+的水解平衡右移,生成Fe(OH)3沉淀。
(3)要实现2NO3-+6H2O+10e-=N2↑+12OH-,该反应应该在阴极中进行,Ag不能作阳极,否则会失去电子,所以Pt是阳极,A是正极;Ag-Pt是阴极,阳极的反应式为:5H2O-10e-=10H++ O2↑,在阳极区生成的H+通过质子交换膜到达阴极区,所以当电解过程中电子转移10 mol时,Δm左=
O2↑,在阳极区生成的H+通过质子交换膜到达阴极区,所以当电解过程中电子转移10 mol时,Δm左= mol×32 g/mol+10 g=90 g,Δm右=28 g-10 g=18 g,当电解过程中电子转移2 mol时,膜两侧电解液的质量变化差Δm左-Δm右=
mol×32 g/mol+10 g=90 g,Δm右=28 g-10 g=18 g,当电解过程中电子转移2 mol时,膜两侧电解液的质量变化差Δm左-Δm右= =14.4 g。
=14.4 g。
