问题
选择题
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8的含有Fe2(SO4)3杂质的CuSO4溶液中加入适量的黑色粉末X,充分搅拌后过滤,将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )
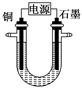
A.黑色粉末X是铁粉
B.铜电极连接电源正极
C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
D.铜的相对原子质量的计算式是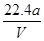
答案
答案:C
利用Fe3+的水解,除去CuSO4溶液中Fe3+方法是向其中加入黑色的CuO,与Fe3+水解产生的H+反应,促进Fe3+水解,使Fe3+转化为Fe(OH)3沉淀而除去,A错误;电解时,石墨作阳极,电极反应式:
4OH--4e-=2H2O+O2↑,C正确;
铜作阴极,电极反应式为:2Cu2++4e-=2Cu,B错误;
据两极上转移电子的量相等可知:
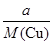 ×2=
×2=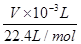 ×4,
×4,
解得:M(Cu)=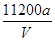 。
。
