(16分)某研究小组拟用粗食盐(含Ca2+、Mg2+、SO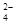 等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:
等)、粗硅(含C及不与Cl2反应的固体杂质)制取纯硅,设计如下的工艺流程:

试回答下列问题:
(1)工业上一般是利用过量焦炭在高温下还原石英砂来制取粗硅,写出该过程的化学方程式:_______________________________________________________________________。
(2)精制粗盐水所需试剂为①BaC12;②Na2CO3;③HC1;④NaOH,其滴加的先后顺序是下列的________(填下列各项的序号)。
a.①②④③ b.④②①③ c.④①③② d.②④①③
已知,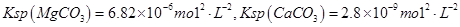 ,假设该粗盐水中
,假设该粗盐水中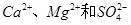 的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
的浓度均为0.01 mol·L-1,若向1 L该粗盐水中逐渐滴入一定量Na2CO3溶液,首先出现的沉淀是__________。
(3)已知SiCl4的沸点是57.6℃,CC14的沸点是76.8℃。在反应器I中得到的SiCl4粗品中含有CCl4,从中得到纯净SiCl4可采用的方法是下列各项中的________(填序号)。
a.蒸馏 b.干馏 c.分液 d.过滤
反应器Ⅱ中发生反应的化学方程式为__________________________________________。
(4)下图是用离子交换膜法电解饱和食盐水的示意图,电解槽中阴极产生的气体是_____。产品A的化学式为____________。
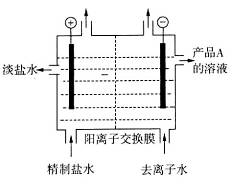
若采用无膜电解槽电解饱和食盐水可制取次氯酸钠,试写出该反应的化学方程式__ ___。
(16分)
(1)SiO2+2C Si+2CO↑(2分)
Si+2CO↑(2分)
(2)a(2分);碳酸钙(或CaCO3)(2分)
(3)a(2分);SiCl4+2H2 Si+4HCl(2分)
Si+4HCl(2分)
(4)氢气(或H2)(2分);NaOH(2分);NaCl+H2O  NaClO+H2↑(2分)
NaClO+H2↑(2分)
题目分析:(1)C在高温条件下还原SiO2,生成Si和CO,化学方程式为:SiO2+2C Si+2CO↑
Si+2CO↑
(2)Na2CO3溶液的作用为除去Ca2+、除去过量的BaCl2溶液,所以Na2CO3的顺序在BaCl2的后面,HCl的作用是除去过量的Na2CO3和NaOH,所以在最后,因此a项正确;因为Ksp(MgCO3) < Ksp(CaCO3),CaCO3更难溶,所以首先析出的沉淀是CaCO3。
(3)SiCl4与CCl4在常温下为液体,相互溶解,但沸点不同,所以用蒸馏的方法得到纯净的SiCl4;反应器II中H2还原SiCl4,化学方程式为:SiCl4+2H2 Si+4HCl。
Si+4HCl。
(4)根据放电顺序,阴极上H2O电离出的H+放电,所以电解槽中阴极产生的气体是氢气;水电离出的H+放电,促进H2O的电离平衡向右移动,OH‾浓度增大,所以产品A为NaOH;无膜电解槽电解饱和食盐水可制取次氯酸钠,电解产生的Cl2与NaOH反应生成次氯酸钠,所以化学方程式为:NaCl+H2O  NaClO+H2↑
NaClO+H2↑
