电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如是电解产生多硫化物的实验装置:

①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是____________________________
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________,
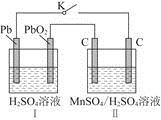
当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的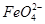 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成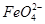

①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=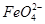 +4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(1)①2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑) 11.2xL
②2S2-+O2+2H2O=2S↓+4OH-
(2)Mn2+-2e-+2H2O=MnO2+4H+
Pb+PbO2+2H2SO4=2PbSO4+2H2O
2 mol 87
(3)增大 4OH--4e-=2H2O+O2↑ 0.28
(1)电解时,水电离的H+在阴极发生得电子还原反应,生成H2。根据电子守恒可知有x mol电子转移,产生H2 0.5x mol。S2-具有较强还原性,易被空气中的氧气氧化,故配制溶液时需要氮气作保护气。
(2)根据题意Mn2+失电子生成MnO2,产物中的氧元素来源于水,生成H+,再将电极方程式配平即可。
(3)图中X极的电极反应为2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-),所以X极区的pH增大,由生成氢气672 mL,可知得电子数为0.06 mol,Y极生成氧气为168 mL,失电子数0.03 mol,由得失电子守恒可知铁失电子数为0.03 mol,由电极反应可知铁溶解为0.005 mol,即0.28 g。