问题
选择题
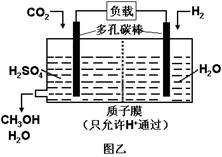
下图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。下列说法不正确的是
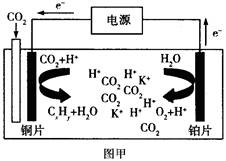
A.甲中铜片作阴极,K+向铜片电极移动
B.乙中正极发生的电极反应为CO2+6e-+6H+=CH3OH+H2O
C.甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2
D.乙中H2SO4的作用是增强溶液的导电性
答案
答案:C
题目分析:A、根据装置图可知,铜片是电子流入的,因此该电极是阴极,溶液中的阳离子向负极移动,A正确;B、乙图中氢气在负极通入,CO2在正极通入,由于存在质子交换膜,因此正极电极反应式为CO2+6e-+6H+=CH3OH+H2O,B正确;C、二氧化碳中碳元素是+4价,甲中若CxHy为C2H4,则生成1 mol C2H4,转移电子的物质的量是2×[4-(-2)]=12mol,所以根据电子得失守恒可知,同时生成3molO2,C不正确;D、硫酸是强酸,完全电离,因此乙中H2SO4的作用是增强溶液的导电性,D正确,答案选C。
