碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
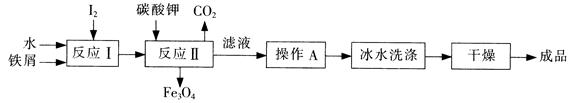
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。

(1)① Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑ (2分)
②加热浓缩、冷却结晶、过滤 (2分)
洗涤除去表面可溶性杂质,同时减少KI的溶解损失 (2分)
(2)①在较高温度下KIO3易分解(2分) ②1700 (2分)
③I一+ 3H2O通电IO3- + 3H2↑ (2分) 不变(2分)
题目分析:(1)①反应I生成铁与碘的化合物,铁元素与碘元素的质量比为21:127,即物质的量比是 =3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。
=3:8,故反应方程式是Fe3I8 + 4K2CO3 = Fe3O4 + 8KI + 4CO2↑。
②用冰水洗涤的目的是洗涤除去表面可溶性杂质,同时减少KI的溶解损失;
(2)①烹饪时,含KIO3的食盐常在出锅前加入,其原因是在较高温度下KIO3易分解;
②因为H2O2氧化I2先制得HIO3:5H2O2+I2==2HIO3+4H2O,即5H2O2~2IO3-,1284 kg KIO3固体为6k mol,故m(H2O2)= 5/2×6kmol×34g·mol-1/30%=1700kg。
③虽然阴极区有大量氢氧根离子生成,但阳极区反应消耗氢氧根离子,氢氧根离子通过阴离子交换膜到阳极区反应,总反应中没有酸或碱生成以及消耗。故而阴极区反应前后pH没有变化。当然,如果题目没有“忽略溶液体积变化“的说明,情况就不同了,随着电解的进行,总反应耗水,阴极区pH会增大。
