(13分)
海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)Cl2的电子式是 。
(2)已知:X2 (g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。
下图表示平衡常数K与温度t的关系。
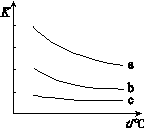
①ΔH 表示X2与H2反应的焓变,ΔH 0。(填“>”、“<”或“=”)
② 曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。

① 装置中由NaCl转化为NaClO的化学方程式是 。
② 海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③ 若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释 。
(13分)
Ⅰ.(1)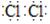 (1分);
(1分);
|
Ⅱ.(1)Al3++3H2O Al(OH)3+3H+ (2分);
Al(OH)3+3H+ (2分);
(2)① 2NaCl+2H2O  2NaOH+Cl2+H2↑ (1分);
2NaOH+Cl2+H2↑ (1分);
2NaOH+Cl2=NaClO+NaCl+H2O (1分);
② Ca2++HCO3-+OH-=CaCO3↓+H2O (2分);
③阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的。 (2分)
题目分析:Ⅰ.(1)氯气分子中的Cl原子之间形成1对共用电子对,所以电子式为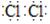
(2)①由图可知,每条曲线都是随温度升高,K值减小,所以升高温度,平衡逆向移动,正反应是放热反应,ΔH<0;
②同一温度时,a曲线的K值最大,说明卤素单质与氢气化合的能力最强,Cl2、Br2和I2中Cl2的氧化性最强,所以最易与氢气化合的是氯气,所以a曲线表示Cl2与H2反应时K与t的关系。
Ⅱ.(1)明矾中的铝离子水解生成氢氧化铝胶体,具有较大的吸附面积,降低浊度。水解的离子方程式为Al3++3H2O Al(OH)3+3H+ ;
Al(OH)3+3H+ ;
(2)① 此装置是电解装置,海水中的氯化钠电解生成氯气、氢气、氢氧化钠,装置中不存在隔气装置,使生成的氯气与氢氧化钠反应生成了次氯酸钠,化学方程式为2NaCl+2H2O 2NaOH+Cl2+H2↑,2NaOH+Cl2=NaClO+NaCl+H2O;
2NaOH+Cl2+H2↑,2NaOH+Cl2=NaClO+NaCl+H2O;
②装置的阴极是氢离子放电,导致阴极的OH-离子浓度增大,与海水中的HCO3-反应生成CO32-,再与Ca2+结合生成碳酸钙沉淀,化学方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O;
③每隔5-10 min倒换一次电极电性,则阴极变阳极,阳极是氯离子放电生成氯气,2Cl--2e-=Cl2↑,氯气溶于水生成盐酸和次氯酸,Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的。
