问题
计算题
某硝酸铵化肥的外包装如右图.请根据包装上的标签计算:
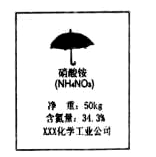
(1)NH4NO3的相对分子质量____
(2)NH4NO3中各元素的原子个数比____
(3)通过计算判断此氮肥样品是纯净物还是混合物.(要求有计算过程)
答案
(1)80(1分) (2)N:H:O=2:4:3(1分)
(3)计算过程:纯硝酸铵中,氮元素的质量分数=35%(要求有过程2分)
35%>34.3%(1分) 是混合物(1分)
析:(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行解答;
(2)根据化学式某元素右下角的数字为该元素原子个数,进行解答;
(3)根据物质中某元素的质量分数=  ×100%,计算NH4NO3中氮元素的质量分数,与包装的含氮量比较,进行解答.
×100%,计算NH4NO3中氮元素的质量分数,与包装的含氮量比较,进行解答.
解答:解:(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得NH4NO3的相对分子质量为:14×2+4+16×3=80; 故答案为:80;
(2)根据化学式某元素右下角的数字为该元素原子个数,可知NH4NO3中各元素的原子个数比为:2:4:3;
故答案为:2:4:3;
(3)根据物质中某元素的质量分数= ×100%,可得NH4NO3中氮元素的质量分数=
×100%,可得NH4NO3中氮元素的质量分数=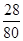 ×100%=35%;
×100%=35%;
因为 35%>34.3%,所以说此氮肥样品是混合物;
答:通过计算判断此氮肥样品是混合物.
点评:本题考查学生对物质的相对分子的质量,物质中某元素的质量分数知识理解与掌握,并能在解题中灵活应用的能力.
