(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:
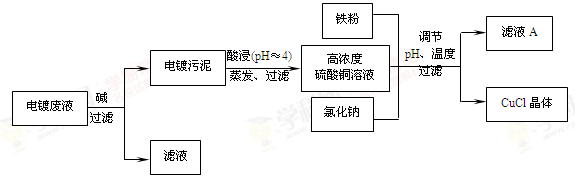
请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
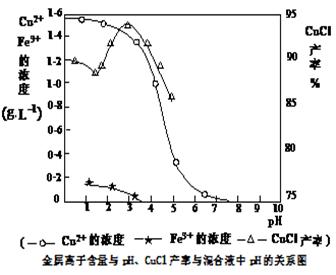
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
(16分)
(1)Cu(OH)2 Fe(OH)3 (每个2分,共4分)
(2)2Cu2++2Cl—+Fe=2CuCl↓+Fe2+(3分,没配平扣1分,无写“↓”不扣分)
(3)3 (2分,写“2.8~3.5”均得分)
(4)促使乙醇和水的挥发,防止CuCl被空气氧化 (2分,写对其中的一点得2分)
(5)Na2SO4和FeSO4(2分;写对其中一个得2分)
(6)Cu2++Cl-+e-===CuCl↓ (3分,无写“↓”扣1分)
题目分析:(1)酸性电镀废液主要含Cu2+、Fe3+,加碱后生成Cu(OH)2 Fe(OH)3,是电镀污泥的主要成分;
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl,同时还有氯化亚铁、硫酸钠生成,离子方程式为2Cu2++2Cl—+Fe=2CuCl↓+Fe2+
(3)由图可知pH=3时CuCl的产率最高,所以析出CuCl晶体时的最佳pH在3左右;
(4)真空干燥时无氧气存在,密封包装也是隔绝氧气,所以真空干燥,密封包装的目的是促使乙醇和水的挥发,防止CuCl被空气氧化;
(5)由流程图可知,氢氧化铁与氢氧化铜与酸反应后生成硫酸铜与硫酸铁,加入铁粉后,溶液中存在硫酸亚铁,氯化亚铜析出后溶液中只剩硫酸亚铁与原来加碱时生成的硫酸钠,所以从滤液A中可回收的主要物质是Na2SO4和FeSO4;
(6)电解池中阴极发生还原反应,元素化合价降低,CuCl2中Cu是+2价,CuCl中Cu是+1价,所以阴极上发生的反应是Cu2++Cl-+e-===CuCl↓。
