甲同学利用如图1的装置进行科学探究.
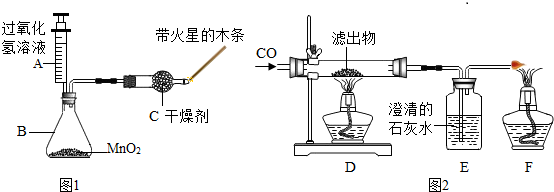
(1)①当A溶液缓慢滴入B装置时,带火星的木条很快复燃,说明生成了______;
②装置C的作用是______;
③写出当A滴入B后发生反应的化学方程式:______;
④试评价甲同学用此装置比用高锰酸钾制氧气具有哪些优点?______.
(2)甲同学用少量氧化铜粉末代替二氧化锰,做同样的实验,结果木条也很快复燃了,然后,甲、乙、丙三位同学作了如下猜测:
甲:过氧化氢分解生成了氧气.乙、______.
丙:氧化铜对过氧化氢分解具有催化作用.
①请你补充乙同学的猜测
②为了验证假设,三位同学进一步做了探究,继续进行如图2实验:待B中物质反应完毕后,把混合物进行过滤、洗净、干燥,然后把滤出物进行如下实验:
③在F中点燃尾气的目的是______;
④观察现象,D中滤出物由黑色逐渐变成______色,B中的澄清石灰水变______,由此得出滤出物的______不改变.
⑤为达到实验的目的,证明氧化铜是否为催化剂,你认为缺少的一个步骤是:______.
(1)①当A溶液缓慢滴入B装置时,带火星的木条很快复燃,说明生成了氧气,因为氧气能使带火星的木条复燃;
②干燥剂的作用是吸收水分,干燥氧气;
③过氧化氢在二氧化锰催化作用下生成水和氧气,方程式是2H2O2
2H2O+O2↑;MnO2 .
④过氧化氢制取氧气和加热高锰酸钾制取氧气相比较具有:不需加热,节约能源,且操作简便,注射器逐滴滴加可节约药品,利于控制反应速率等优点;
(2)①药品中还有氧化铜,结合甲、丙同学的猜想,还可能是氧化铜分解生成氧气;
③一氧化碳有毒,为防止其污染大气,故在F中点燃尾气;
④一氧化碳可还原氧化铜生成红色的铜和二氧化碳,因此若观察到黑色粉末变红,澄清石灰水变浑浊,则说明氧化铜的化学性质不变;
⑤要证明氧化铜是反应的催化剂,还应称量氧化铜反应前后质量是否改变;
故答案为:(1)①氧气;②吸收水分,干燥氧气;③2H2O2
2H2O+O2↑;④不需加热,节约能源;节约药品;操作简便;有利于控制反应速率等;(2)①氧化铜分解生成了氧气;③防止尾气污染空气;④红,浑浊,化学性质;⑤称量氧化铜反应前后的质量是否发生变化.MnO2 . .
