下图是某品牌补铁剂的标签。请据图回答:

(1)富马酸亚铁颗粒中的铁属于 元素(填“常量”或“微量”);
(2)富马酸亚铁中C、H元素的质量比为 ;
(3)富马酸亚铁的相对分子质量是 ;
(4)已知富马酸亚铁(C4H2FeO4)中铁元素的质量分数为33%,
若每次服用1包该补铁剂,摄入铁元素的质量为 mg。
(1)该黄铜样品中锌的质量为6.5g。(2)反应后所得溶液的溶质质量分数为15.2%。
(1)黄铜中的铜不与硫酸反应,锌与硫酸反应,根据反应的方程式由氢气的质量就可以求出锌的质量,进而求出该黄铜样品中铜的质量分数;
(2)根据锌与硫酸反应的方程式,由氢气的质量就可以求出稀硫酸中硫酸的质量,根据溶质质量分数的计算公式求出原稀硫酸溶液中溶质质量分数.
解:设与100g质量分数为9.8%的稀硫酸反应的锌的质量为x,
同时生成ZnSO4和H2的质量分别为Y和Z
Zn + H2SO4 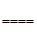 ZnSO4 + H2↑
ZnSO4 + H2↑
65 98 161 2
X 100×9.8% y z
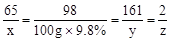 解得:X=6.5g,Y=16.1g,Z=0.2g
解得:X=6.5g,Y=16.1g,Z=0.2g
∴反应后所得溶液的溶质质量分数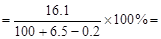 15.2%
15.2%
答:(1)该黄铜样品中锌的质量为6.5g。(2)反应后所得溶液的溶质质量分数为15.2%。
