问题
问答题
海水的综合利用可以制备金属镁,其流程如下图所示
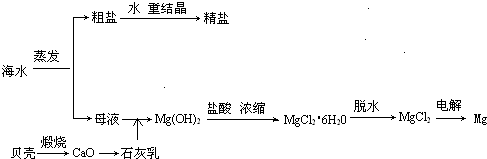
(1)制取金属镁时,可以用电解MgCl2的方法,写出相应的反应的化学方程式______.
(2)电解无水氯化镁产物之一的Cl2可与氧气、甲烷起反应(产物为HCl、CO),再制得盐酸使用,写出该反应的化学方程式并标出电子转移的方向和数目.______.
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:______;
过滤时:______;
蒸发时:______.
答案
(1)工业制镁采用电解法:MgCl2
Mg+Cl2↑,故答案为:MgCl2 电解 .
Mg+Cl2↑; 电解 .
(2)Cl2与氧气、甲烷起反应生成物为HCl、CO,所以:4Cl2+O2+2CH4═8HCl+2CO,故答案为:
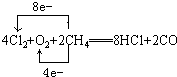
(3)在溶解操作中,玻璃棒起到搅拌以加快食盐的溶解的作用;过滤操作中,玻璃棒用以引流而防止液体外洒,冲破滤纸;蒸发操作中,玻璃棒起到搅拌而使液体受热均匀,防止因局部过热液滴或晶体飞溅;
故答案为:搅拌,加速溶解;引流,防止液体外洒,冲破滤纸;搅拌,防止因局部过热造成液滴飞溅;
