过氧化钠(化学式为Na202)可用在呼吸面具中作为氧气来源。Na202能跟C02
反应生成02和另一种固体化合物(用X表示);它也能跟H20反应生成02,化学方程式
为:2Na202+2H20=4NaOH+02↑。以下是某兴趣小组进行的探究活动。
(1)利用如下图所示实验装置制取氧气,请回答有关问题。
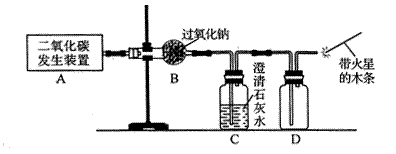
①实验室制取CO2的化学方程式为 。
②表明C02未被Na202完全吸收的实验现象为 。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的哪些性质?
④若A装置产生的C02中混有水蒸气,要检验干燥的C02能否与Na202反应生成
O2,以上实验装置应如何改进?
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是 。
②同学们通过讨论和实验证明了X是Na2C03。以下是他们设计的有关Na2C03性质的探究实验,请根据卷首资料提供的信息,将下表填写完整。
| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品, |
澄清石灰水变浑浊 | Na2C03+2HCl=2NaCl+H 20+C02↑ C02+Ca(OH)2=CaC03↓+H2 0 |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量 的 溶液 | 有白色沉淀产生 |
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g
氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
(1)CaC03+2HCl==CaCl2+H20+C02↑
②澄清石灰水变浑浊
③氧气密度比空气的大,氧气有助燃性。
④在A、B装置之间和B、C装置之间增加气体干燥装置(答出在A、B装置之间增加
气体干燥装置即可)。
 (2)①Na202和C02都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢
(2)①Na202和C02都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢
元素的酸或碱
② ’
| 实验操作 | 现 象 | 有关的化学方程式 |
滴加稀盐酸,然后 将产生的 将产生的气体通入澄清石灰水 | 有气泡产生 ( | |
| 氯化钙或 氯化钡等 | Na2C03+CaCl2=CaC03↓+2NaCl或 Na2C03+BaCl2=BaC03↓+2NaCl等 |
(3)解:设生成氧气的质量为x,生成氢氧化钠的质量为y。
2Na202+2H20=4NaOH+02↑
156 160 32
7.8g y x
X=1.6g
Y=8g
氢氧化钠溶液中溶质的质量分数为:
8g/40g×100%=20%
答:略。
(1)①实验用大理石或石灰石与稀盐酸反应制取CO2气体,其反应的化学方程式为CaCO3+2HC1=CaC12+H2O+CO2↑;②装置C是检验CO2是否被完全吸收的,若澄清石灰水变浑浊,表明CO2未被完全吸收;③在收集装置中“长进短出”说明了O2的密度大于空气密度,且氧气能助燃;④A中产生的CO2中带有水蒸气,要除去需在A和B间增加气体干燥装置,要保证是干燥CO2与Na2O2反应还需在B、C之间增加干燥装置,以防C装置中水蒸气进入B干扰实验。(1)①由质量守恒定律知:反应前后原子的种类不会改变,即Na2O2和CO2反应不可能生成酸和碱中的氢元素;②Na2CO3的检验要加入稀HC1观察是否有气泡产生,为了排除产生所体的氢气,常将产生的气体通入澄清石灰水中观察其是否变为浑浊,从而确定碳酸盐的存在,也可加入含Ca2+或Ba2+的溶液(如CaC12、BaC12等)看是否有沉淀生成。③生成氧气的质量可由参加反应的7.8g Na2O2利用化学方程式求得,同时生成NaOH的质量也可由7.8g Na2O2的质量求得,然后利用溶质质量分数的计算公式,求得NaOH溶液中溶质的质量分数
