下图A~F是实验室制备某些常见气体的装置示意图。
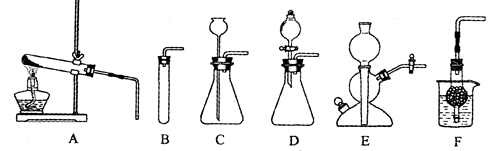
(1)实验室制备CO2的化学方程式为: ▲
可用的发生装置有: ▲ (选填上图字母序号)。
(2)装置E或F相对于装置C在操作方面的优势为: ▲ 。
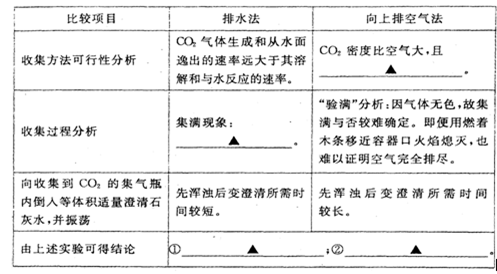
(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
(4)块状石灰石和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH等于2。此时取适量反应后溶液,逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下[pH为纵坐标,时间s(秒)为横坐标]:
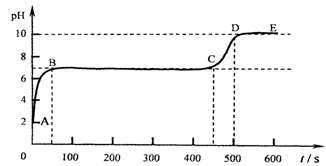
①写出AB段内有关化学方程式 ▲ ,
▲
②写出BC“平台”段化学方程式 ▲ 。
③CD段上升的原因是: ▲ 。

分析:(1)实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳;根据反应物的状态和反应条件确定发生装置.
(2)从操作是否简便、是否节约药品、是否节能环保、应用是否方便等角度进行考虑.
(3)从选择气体收集方法的依据和收集气体时的操作注意事项进行分析.
(4)先确定残留液中的溶质,根据残留液溶质的酸碱性确定AB段、BC段发生反应的化学方程式,CD段上升,说明溶液的碱性逐渐增强.
解答:解:(1)大理石(或石灰石)的主要成份是碳酸钙,盐酸的溶质是氯化氢气体,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳;反应物的状态是固态和液态,反应条件是常温,应选固-液不加热型的发生装置.
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑; B、C、D、E、F
(2)E装置:打开弹簧夹,从装置下面的开口处加入固体药品,从上面的开口处加入液体药品,反应开始,夹住弹簧夹,装置内的气体压强增大,使液体药品进入长颈漏斗并且上升,固体药品和液体药品分离,反应停止;F装置:固体药品放在球行管中,液体药品放在烧杯中,把球行管放入液体药品中,反应开始,把球行管拿出液体药品,反应停止.
故答案为:能随时控制反应的发生和停止
(3)能用向上排空气法收集的气体必须满足密度比空气大,不与空气发生反应等条件;用排水法收集气体时,当看到集气瓶口有气泡冒出,说明集气瓶中的水已排完,气体已收集满;通过实验分析可知,二氧化碳可用排水法或向上排空气法收集,用排水法收集二氧化碳时能看到什么时候收集满,而用向上排空气法则不能,因而用排水法收集到的二氧化碳比较纯净.
故答案为:
| 不与空气发生反应 | ||
| 集气瓶口有气泡冒出 | ||
| 二氧化碳可用排水法或向上排空气法收集; 用排水法收集到的二氧化碳比较纯净. |
②残留液中除了有盐酸外,还有石灰石与盐酸反应生成的氯化钙,氯化钙溶液显中性,会和碳酸钠反应生成显中性的碳酸钙和显中性的氯化钠.故答案为:CaCl2+Na2CO3=2NaCl+CaCO3↓
③碳酸钠溶液显碱性,当盐酸、氯化钙反应完后继续滴加碳酸钠溶液,溶液也会显碱性,PH会逐渐增大.故答案为:碳酸钠溶液显碱性
