实验是学习化学的重要手段,通过实验可以培养实践能力和创新精神。
(一)实验室制取气体是初中重要的一组实验,结合下列实验装置图回答有关问题:

(1)装置Ⅰ是加热固体的装置,指出其中的错误 ;要改正错误需要操作的按钮时 (填字母)。
(2)使用装置Ⅱ制取O2, 化学方程式为 。
(3)使用装置Ⅱ前要检验气密性,方法是 。
(4)实验室制取H2、O2、CO、CO2、NH3等五种气体,可选用装置Ⅲ来收集的气体有 (填化学式)。
(二)某实验小组为测定铜和氧化铜混合物中氧化铜的质量分数,设计了用干燥纯净的氢气还原氧化铜的实验,所需实验装置如下图所示,回答下列问题:
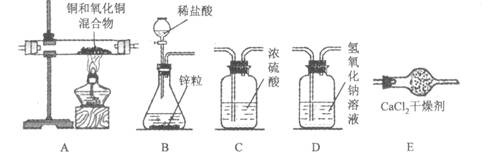
(5)将上图连接成整套装置,连接顺序依次为B→ → → →E(填写字母)。
(6)A装置中实验前混合物质量为2.5g,实验后的剩余固体质量为2.1g,则混合物中的质量分数为 。
(7)某同学用E装置增加的质量来计算混合物中氧化铜的质量分数,计算的结果会 (填“增大”、“减少”或“不变”)
(1)试管口向上倾斜(或试管口没有略向下倾斜) AB
(2)2H2O2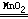 2H2O+O2↑
2H2O+O2↑
(3)夹紧装置中导管的橡胶管,在长颈漏斗中加少量水,长颈漏斗中的水保持不下去
(4)H2、O2、CO
(5)D→C→A
(6)80%
(7)偏大
分析:(一)(1)固体加热时试管应略微向下倾斜.
(2)II是固液制气的发生装置,据此回答问题即可.
(3)该装置一般是采用液封法进行气密性的检验.
(4)利用III装置收集气体要保证该气体不易溶于水.
(5)实验室若用锌和稀盐酸制取氢气时,因盐酸易挥发,所以制得的氢气内混有少量HCl气体和水蒸气,欲得到纯净、干燥的H2,必须除掉HCl气体和水蒸气.
(6)利用反应前后减小的是氧化铜中的氧,对氧化铜的质量进行计算.
(7)玻璃管中的水蒸气全部被E吸收,并且E还吸收了部分空气中的水,使E增加的质量变大;
解:
(1)固体加热时试管应略微向下倾斜,否则容易炸裂试管.
(2)II是固液制气的发生装置,制取氧气是双氧水与二氧化锰的反应是固液制气型.
(3)该装置一般是采用液封法进行气密性的检验,及切断与外界的联通向长颈漏斗中注水,观看液面的变化.
(4)利用III装置收集气体要保证该气体不易溶于水,氢气氧气一氧化碳均不易溶于水.
(5)验室若用锌和稀盐酸制取氢气时,因盐酸易挥发,所以制得的氢气内混有少量HCl气体和水蒸气,欲得到纯净、干燥的H2,必须先用装置D除掉HCl气体再用装置C除掉水蒸气后用装置E收集(氢气密度最小),因为装置D内盛的是氢氧化钠溶液能很快吸收HCl气体发生化学反应.
(6)反应前后固体的质量差是2.5g-2.1g=0.4g,则氧化铜的质量是
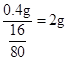 ,氧化铜的质量分数为
,氧化铜的质量分数为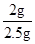 ×100%=80%
×100%=80%
(7)在高温条件下,玻璃管中的水蒸气全部被E吸收,并且E还吸收了部分空气中的水,使E增加的质量变大,从而使计算出的结果和实际值相比将偏大.
故答案为:(1)试管口向上倾斜(或试管口没有略向下倾斜) AB
(2)2H2O2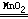 2H2O+O2↑(3)夹紧装置中导管的橡胶管,在长颈漏斗中加少量水,长颈漏斗中的水保持不下去
2H2O+O2↑(3)夹紧装置中导管的橡胶管,在长颈漏斗中加少量水,长颈漏斗中的水保持不下去
(4)H2、O2、CO (5)D→C→A (6)80% (7)增大.

 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑