A、B、C、D、E五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3•H2O、Na2CO3中的一种.常温下进行下列实验:
Ⅰ.将一定体积pH=10的A溶液分别与0.01mol•L-1x升B溶液、0.01mol•L-1y升C溶液充分反应至中性时,x、y大小关系为:y<x;
Ⅱ.浓度均为0.1mol•L-1D与C溶液等体积混合,溶液呈酸性.
Ⅲ.浓度均为0.1mol•L-1A和E溶液的pH:A<E
请回答下列问题:
(1)B是______溶液(填溶质的化学式).理由是______
(2)用水稀释0.1mol•L-1D时,溶液中随着水量的增加而减小的是______(填写序号)
①c(D)/c(OH-);②c(OH-)/c(H+);③c(H+)和c(OH-)的乘积④OH-的物质的量
(3)将C溶液逐滴滴加到A溶液中,不断振荡,当滴加到A、C等物质的量时,溶液中所有阴离子的物质的景浓度由小到大的顺序是______.
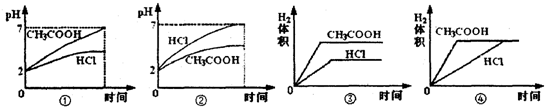
(4)在体积均为1L,pH均等于2的盐酸和醋酸溶液中分别投入0.23gNa,则下图中比较符合反应事实的曲线是______.
先将溶液分为两类:酸性溶液为:HCl、CH3COOH;碱性溶液:NaOH、NH3•H2O、Na2CO3,
根据Ⅰ可知A为碱性溶液,则B、C为酸性溶液,即B、C为:HCl、CH3COOH,
分别与0.01mol•L-1x升B溶液、0.01mol•L-1y升C溶液充分反应至中性时,x、y大小关系为:y<x,C的用量少,说明B的酸性C酸性比弱,所以B是CH3COOH,C为HCl,
由Ⅱ可知,浓度均为0.1mol•L-1D与C溶液等体积混合,溶液呈酸性,应生成强酸弱碱盐,则C为HCl,则D为NH3•H2O,
再根据Ⅱ可知,D为氨水,最后根据Ⅲ浓度均为0.1mol•L-1 A和E溶液的pH:A<E,可以推断A为Na2CO3,E为NaOH,
(1)由Ⅰ可知,中和碱性物质A只有盐酸和醋酸,等物质的量的A分别与等物质的量浓度B和C混合呈中性,C的用量少,说明B的酸性C酸性比弱,所以B是醋酸,
故答案为:CH3COOH;中和碱性物质A只有盐酸和醋酸,等物质的量的A分别与等物质的量浓度B和C混合呈中性,C的用量少,说明B的酸性C酸性比弱,所以B是醋酸;
(2)用水稀释0.1mol•L-1 NH3•H2O时,促进NH3•H2O的电离,则OH-的物质的量增大,NH3•H2O物质的量浓度减小,但由于体积增大,OH-浓度反而减小,则c(H+)增大,
则①②减小,由于温度不变,③不变,④增大,
故答案为:①②;
(3)将HCl溶液逐滴滴加到Na2CO3溶液中,不断振荡,当滴加到HCl、Na2CO3等物质的量时,恰好生成NaHCO3,由于HCO3-部分水解呈碱性,则c(OH-)<c(HCO3-)<c(Cl-),且水解大于电离,则c(CO32-)<c(OH-),所以c(CO32-)<c(OH-)<c(HCO3-)<c(Cl-),
故答案为:c(CO32-)<c(OH-)<c(HCO3-)<c(Cl-);
(4)pH均等于2的盐酸和醋酸溶液中分别投入0.23gNa,钠均完全反应,盐酸完全反应,醋酸剩余,生成氢气的体积相同,因醋酸为弱酸,则醋酸浓度大,反应速率较大,HCl的pH变化较大,则正确的图象为②④,
故答案为:②④.
