室温时,向100mL0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是______;
(2)在b点,溶液中各离子浓度由大到小的排列顺序是______;
(3)在cd段发生反应的离子方程式______.
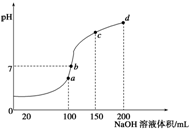
(1)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,所以a点水的电离程度最大,故答案为:a;
(2)b点溶液为中性,溶质为(NH4)2SO4与Na2SO4、NH3•H2O,V(NaOH)>V(NH4HSO4),铵根离子水解,则离子浓度大小为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
(3)cd段发生铵根离子与碱的反应,该离子反应为NH4++OH-=NH3•H2O,故答案为:NH4++OH-=NH3•H2O.

