问题
计算题
钙是维持人体正常功能所必需的元素。
如图所示为某种补钙剂“钙尔奇”说明书的一部分。取1片钙尔奇,放入盛有10 g稀盐酸的烧杯中,其中碳酸钙跟盐酸恰好完全反应(其他成分与盐酸不反应)。烧杯内物质质量变为11.34 g。试计算:
| 钙尔奇 caltrate 主要成分:CaCO3 规格:每片2.0 g 用法:口服 用量:一日2次,每次1片 |
(1)每片钙尔奇中含碳酸钙的质量。
(2)服用这种补钙剂,每人每天摄入钙元素的质量。
(3)所用稀盐酸中溶质的质量分数。
答案
(1)1.5 g (2)1.2 g (3)10.95%
(1)设每片钙尔奇中含碳酸钙的质量为x。
根据反应前后质量守恒,可知生成CO2的质量为
10 g+2.0 g-11.34 g=0.66 g
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.66 g
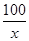 =
=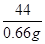
x=1.5 g
(2)由(1)可知每片钙尔奇中含碳酸钙的质量为1.5 g,其中钙元素的质量为
1.5g×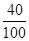 ×100%=0.6 g
×100%=0.6 g
根据用量“一日2次,每次1片”可知,每人每天摄入钙元素的质量为0.6 g2=1.2 g。
(3)设所用稀盐酸中溶质的质量分数为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
236.5 44
10 gy 0.66 g
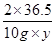 =
=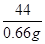
y=10.95%
