(2011年山东济南,44题)如图16所示为实验室中常见气体的制备、净化、收集和性质实验的部分仪器是根据题目的要求,回答下列问题:
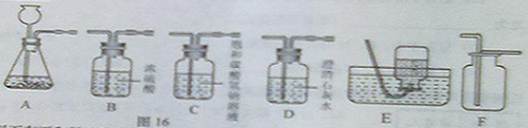
(1)以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳气体。(提示:盐酸中挥发出的少量HCl气体可以用饱和的碳酸氢钠溶液吸收)
①所选仪器的连接顺序 (填写仪器的序号字母)
②生成二氧化碳时,所发生反应的化学方程式
(2)为探究二氧化碳的性质,进行如下实验。
①将二氧化碳通入水中,用PH试纸粗略测定二氧化碳水溶液的酸碱性强弱,请简述测定的方法 。
②将二氧化碳通入氢氧化钠溶液中,并无明显反应现象。欲用化学方法证明CO2和NaOH溶液确实发生了化学反应,请从NaCl溶液、CaCl2溶液、稀盐酸三种试剂瓶中选用一种试剂进行实验,简述证明的理由
③将少量的CO2气体通入盛有大量澄清Ca(OH)2溶液的大烧杯中,烧杯中溶液的质量与之前相比会 (填写下列各项序号)
A.增大
B.减小
C.不变
D.无法判断
(1)ACBF CaCO3+2HCl==CaCl2+H2O+CO2↑
(2)用玻璃棒蘸取少量的待测液于PH试纸上,然后与标准比色卡对照。
取少量反应后的溶液,滴入CaCl2溶液,产生白色沉淀,证明CO2和NaOH溶液确实发生了化学反应。
(3)B
分析:(1)①根据二氧化碳的性质可以知道干燥可以用浓硫酸,而吸收氯化氢气体可以用饱和的碳酸钠溶液,可以据此来解答该题;
②石灰石的主要成分为碳酸钙,碳酸钙和稀盐酸反应生成了氯化钙、水和二氧化碳,可以据此解答;
(2)①根据pH试纸的使用方法来测定二氧化碳水溶液的酸碱度;
②二氧化碳和氢氧化钠反应生成了碳酸钠,可以根据碳酸钠的性质来选择合适的试剂;
③二氧化碳和氢氧化钙反应生成了碳酸钙沉淀,所以可以据此来分析并作出判断.
解答:解:(1)①为了得到干燥的二氧化碳应该先用饱和的碳酸钠溶液来吸收氯化氢,然后在干燥,故仪器的连接顺序为:ACBF;
②石灰石的主要成分为碳酸钙,碳酸钙和稀盐酸反应生成了氯化钙、水和二氧化碳,故可以写出该反应的化学方程式;
(2)①用pH试纸来测定二氧化碳的水溶液时,可以用玻璃棒蘸取溶液滴到pH试纸上,然后跟标准比色卡对照,读出数值即可;
②二氧化碳和氢氧化钠反应生成了碳酸钠,而碳酸钠可以和氯化钙反应生成碳酸钙沉淀,故可以用氯化钙溶液来证明;
③将二氧化碳通入澄清石灰水中,二氧化碳和氢氧化钙反应生成了碳酸钙沉淀,而使溶液中的溶质减少,故溶液的质量要减少,所以B选项是正确的,故选B.
故答案为:
(1)①ACBF;②CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)①用玻璃棒蘸取溶液滴到pH试纸上,然后跟标准比色卡对照,读出数值;②取少量反应后的溶液,滴入CaCl2溶液,产生白色沉淀,证明CO2和NaOH溶液确实发生了化学反应;③B.
