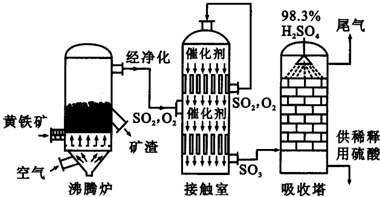
以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)将燃烧黄铁矿的化学方程式补充完整4______+11O2
2Fe2O3+8SO2 高温 .
(2)接触室中发生反应的化学方程式是______.
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)______.
a.为使黄铁矿充分燃烧,需将其粉碎b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是______.
(5)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得c(SO3)=0.040mol/L.则该条件下SO2的平衡转化率为______.
(6)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其原因是______.
(1)依据题意,黄铁矿是制硫酸的第一步所需的原料,由成分可知化学式为FeS2,故答案为:FeS2;
(2)沸腾炉中生成的二氧化硫气体和空气中的氧气在接触室内发生的催化氧化反应生成三氧化硫;2SO2+O2
2SO3 故答案为:2SO2+O2催化剂 . △
2SO3;催化剂 . △
(3)粉碎矿石增大接触面积提高反应速率;增加空气的量会使平衡正向进行,提高了二氧化硫的转化率;催化剂只改变速率不改变平衡,不改变转化率;生产过程中的矿渣中含有三氧化二铁;所以正确的是abd;故答案为:abd;
(4)SO2吸收Br2的反应中二氧化硫被氧化为硫酸,溴单质被还原为溴化氢,离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;
(5)平衡时生成三氧化硫的物质的量为0.040mol,根据化学平衡计算如下:
2SO2 +O2
2SO3催化剂 . △
起始量 0.05mol 0.03mol 0
变化量 0.040mol 0.02mol 0.040mol
平衡量 0.01mol 0.01mol 0.04mol
二氧化硫的转化率=
×100%=80%,0,04 0.05
故答案为:80%;
(6)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,是防止亚铁盐被氧化,可制备FeSO4.酸溶过程中需保持溶液足够酸性,防止Fe2+、Fe3+的水解,
故答案为:抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+.
