(三选一)【化学与技术】
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在_________(填编号)的郊区。
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t98%的硫酸需消耗3.6×10kJ能量。请通过计算判断,若反应:SO2(g)+O2(g)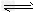 SO3(g) △H=-98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t98%的硫酸只需外界提供(或可向外界输出)____kJ能量。
SO3(g) △H=-98.3kJ/mol放出的热量能在生产过程中得到充分利用,则每生产1t98%的硫酸只需外界提供(或可向外界输出)____kJ能量。
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为___________________。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4 (由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)。

已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因是_____________________
(1)C
(2)6.23×105
(3)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2
4CuO+2Fe2O3+8SO2
(4)SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡逆向移动,SO3的物质的量减少,所以CuSO4的量减少(或温度升高,SO3的物质的量减少,故CuSO4的量减少)
