(10分,每空2分)现要制取一些二氧化氮气体来做演示分子运动的实验。已知二氧化氮气体可以
通过铜和浓硝酸反应得到,其化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。二氧化氮是一种红棕色的气体,密度比空气大,能和水反应生成HNO3和NO气体,NO则为一种无色气体,难溶于水,一遇到O2就会变成NO2,NO和NO2都是大气污染物。现给出下列装置(A~G),请回答有关问题:
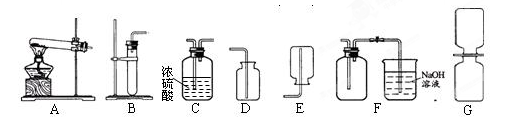
(1)制取一瓶干燥的二氧化氮气体时,所选择的装置依次为 (填序号);
(2)收集NO气体时应用_________________法;
(3)写出二氧化氮和水反应的化学方程式 ;
(4))用如上图G装置演示分子运动时,为了缩短演示的时间,NO2最好放在_________(选填“上”或“下”)面的集气瓶中,另一瓶是空气,抽去两瓶之间的玻璃片,可以观察到的现象是: 。
(1)B、C、F;(2)排水;(3)3NO2+H2O==2HNO3+NO;
(4))上 上瓶气体颜色逐渐变浅,下瓶气体颜色逐渐加深,最后颜色相同
(1)二氧化氮气体可以通过铜和浓硝酸在常温下反应得到,所选的发生装置应该是固-液不加热型B,二氧化氮能和水反应,不能用排水集气法收集.密度比空气大,可用向上排空气法收集,但二氧化氮又会污染空气,所以要加一个吸收二氧化氮的尾气处理装置.题中要求收集一瓶干燥的二氧化氮气体,要先通过浓硫酸干燥再收集.
故选B、C、F
(2)一氧化氮能与空气中的氧气反应,不能用排空气法收集,一氧化氮难溶于水,可用排水法收集.故答案为:排水
(3)题目中已说明二氧化氮和水反应会生成硝酸和一氧化氮,只要配平就可以了.故答案为:3NO2+H2O═2HNO3+NO
(4)因为二氧化氮的密度比空气大,把二氧化氮放在上面的集气瓶中的话,二氧化氮分子会迅速向下运动,会加快二氧化氮和空气混合均匀的时间.
故答案为:上 因为分子是在不断的运动,故答案为:上瓶气体颜色逐渐变浅,下瓶气体颜色逐渐加深,最后颜色相同
