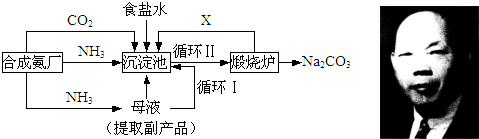
我国化学侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
沉淀池中四种盐在不同温度下的溶解度(g/100g水)表
| 温度溶解度盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
请回答:
(1)沉淀池中反应温度控制在30℃~35℃,是因为若高于35℃,则______,若低于30℃,则______;为控制此温度范围,采取的加热方法为______.
(2)沉淀池中发生的化学反应方程式是______.
(3)副产品的一种用途为______,写出上述流程中X物质的分子式______.
(4)加料完毕后,继续保温30分钟,目的是______.静置后只析出NaHCO3晶体的原因是______.用蒸馏水洗涤NaHCO3晶体的目的是除去______杂质(以化学式表示).
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加______.
(1)根据题意“35℃NH4HCO3会有分解”,所以温度不能超过35℃;同时反应速度受温度影响,温度太低反应速率太慢,所以温度必须控制在一个合理范围内,使温度保持一个恒定,因为控制的温度在100℃以下,所以常用水浴加热来控制,
故答案为:NH4HCO3分解;反应速率降低;水浴加热;
(2)目前工业制碱方法有二:氨碱法和联合制碱法.题中方法由我们侯德邦所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
(3)得到碳酸氢钠同时得到氯化铵,故副产物为氯化铵,氯化铵可用来制作化肥,也可用作焊药或电解液;煅烧炉中发生的反应是碳酸氢钠受热分解,生成纯碱、二氧化碳气体和水,所以X是二氧化碳,故答案为:化肥或电解液或焊药等;CO2;
(4)因为反应不是瞬间完成的,所以要保持一段时间,以使反应充分;由溶解度表可看出在30℃~35℃之间,碳酸氢钠的溶解度最小,所以析出的只能是碳酸氢钠;
因为未反应完的氯化钠、碳酸氢铵及生成的氯化铵会附着在碳酸氢钠晶体表面,所以要用蒸馏水进行洗涤,以便除去杂质;
故答案为:使反应充分进行;NaHCO3的溶解度最小;NaCl、NH4Cl、NH4HCO3;
(5)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,
故答案为:稀硝酸和硝酸银溶液.
