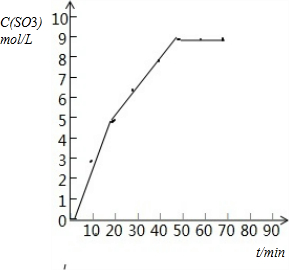
(1)下表为某温度和压强下,密闭容器中SO2氧化为SO3反应在不同时间各物质的浓度(mol/L)
| 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7%,O2:11%,N2:82%):
| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
②在400一500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:______.
③工业制硫酸所产生的尾气含有SO2、微量的SO3和酸雾.为了保护环境将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______.
④能用于测定硫酸尾气中SO2含量的是______.(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
⑤某温度下,SO2氧化为SO3在10L的密闭容器中进行,开始向容器加入4.0mol SO2和10.0mo1O2,当反应达到平衡时,混合气体为13.0mol,则SO2的转化率为______,该温度反应的平衡常数______.
(1)根据表中数据分析,起点三氧化硫生成的量为0,反应到50min后,三氧化硫浓度不再变化,说明已达到平衡,依据各点数据在坐标系中描点连线,画出变化曲线如图:
故答案为:

;
(2)①依据数据分析,压强一定时,温度升高,二氧化硫的转化率减小,说明升温平衡向逆反应方向移动,所以二氧化硫的氧化反应为放热反应,
故答案为:压强一定时,温度升高,二氧化硫的转化率减小,说明升温平衡向逆反应方向移动,所以二氧化硫的氧化反应为放热反应;
②压强及温度对S02转化率的影响依据表中数据,400℃~500℃时,1标准大气压时二氧化硫转化率为97.8%、99.7%;10大气压时二氧化硫转化率为99.3%、99.7%;对比数据可知,增大到10个大气压,二氧化硫转化率变化不大,但增大压强会对设备要求更高,成本高,所以工业上直接采用常压;
故答案为:从化学平衡移动条件分析应该采用低温高压.而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,反而增加成本,所以工业上直接采用常压;
③尾气含有S02、微量的S03和酸雾,其中二氧化硫会发生反应生成亚硫酸、亚硫酸铵、亚硫酸氢铵,这些物质易被氧化;故答案为:2H2SO3+O2=2H2SO4; 2NH4HSO3+O2=2NH4HSO4;2(NH4)2SO3+O2=2(NH4)2SO4中的任意两个;
④测定硫酸尾气中S02含量,尾气中含有三氧化硫,需要加入与二氧化硫反应的试剂,不与三氧化硫反应,且现象明显;Na0H溶液、酚酞试液和氨水、酚酞试液;和二氧化硫、三氧化硫反应,所以不能准确测定二氧化硫的含量;KMnO4溶液、稀H2SO4和二氧化硫反应,全部反应的现象是到溶液紫红色恰好褪去;和碘水、淀粉溶液反应,二氧化硫全部反应的现象是蓝色恰好变为无色;上述高锰酸钾、碘单质和二氧化硫反应,与三氧化硫不反应,所以利用反应,计算被试剂吸收的二氧化硫,得到二氧化硫的含量;故答案为:BC.
⑤根据二氧化硫氧化为三氧化硫的反应列式计算,设变化的二氧化硫物质的量为X
2SO2 +O2
2SO3催化剂 . △
起始量(mol) 4.0 10.0 0
变化量(mol) X 0.5X X
平衡量(mol) 4.0-X 10.0-0.5X X
( 4.0-X )+(10.0-0.5X )+X=13.0
解得X=2mol
二氧化硫的转化率=
×100%=50%,k=2mol 4mol
=[SO3]2 [O2][SO2]2
=1.1L•mol-1(
)22 10 9×(
)22 10
故答案为:50%;1.1L•mol-1
